|
MỤC TIÊU GIẢNG DẠY
Biết phân biệt mẫn cảm thụ động và chủ động và các ví dụ
Phân biệt giữa mẫn cảm tự nhiên và nhân tạo Biết các ứng dụng và các vấn
đề của mẫn cảm thụ động nhân tạo
Biết các ứng dụng và các vấn đề về mẫn cảm chủ động nhân tạo
Biết cách tiếp cận hiện đại với mẫn cảm
|
Mẫn cảm là một biện pháp cung cấp sự bảo vệ đặc hiệu chống lại
nhiều tác nhân gây bệnh phổ biến bằng cách kích thích hệ thống miễn dịch của một
sinh vật để sản xuất các kháng thể dịch thể chống lại tác nhân gây bệnh (hoặc
các độc tố được tạo ra bởi tác nhân gây bệnh) hoặc tế bào T có thể cung cấp miễn
dịch qua trung gian tế bào. Loại mẫn cảm cần cho trung
hòa một tác nhân gây bệnh đặc hiệu phụ thuộc vào các vị trí của các tác nhân gây
bệnh và cơ chế bệnh sinh của nó. Ví dụ, một số tác nhân gây bệnh bằng cách tiết
ra ngoại độc tố. Nếu xảy ra, chỉ có một cơ chế miễn dịch hiệu quả chống lại các
sinh vật là kháng thể sẽ trung hòa ngoại độc tố, ngăn cản độc tố liên kết với
các thụ thể thích hợp trên tế bào đích và thúc đẩy sự dọn dẹp và phân hủy bằng
cách thực bào.
Nếu tác nhân gây bệnh sinh bệnh bằng các biện pháp khác, một
kháng thể sẽ có phản ứng với tác nhân gây bệnh và loại bỏ nó bằng cách ly giải
thông qua hoạt hóa bổ thể hoặc thực bào và tiêu diệt nội bào. Tuy nhiên, nếu các
sinh vật gây bệnh nằm trong tế bào, nó sẽ không gặp được kháng thể và tế bào
chứa chấp nó sẽ phải được tiêu huỷ thay, sau đó kháng thể mới có thể có bất kỳ
tác dụng trên mầm bệnh. Hầu hết các virút, cùng với vi khuẩn nội bào và động vật
nguyên sinh, là những ví dụ về tác nhân gây bệnh đó. Trong trường hợp này, các
tế bào chứa chấp có thể bị phá hủy bởi các thành phần của miễn dịch qua trung
gian tế bào, hoặc, nếu chúng làm tế bào bị nhiễm biểu lộ kháng nguyên độc nhất
được nhận biết bởi kháng thể, sự tiêu diệt các tế bào nhiễm qua trung gian kháng
thể và bổ thể nhờ vào các thành phần miễn dịch dịch thể. Cũng có thể các tế bào
chứa tác nhân gây bệnh nội bào được hoạt hóa để diệt các tác nhân gây bệnh. Điều
đó sẽ tiêu diệt các tác nhân gây bệnh có khả năng sống sót trong các tế bào thực
bào.
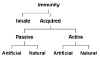
Miễn dịch đặc hiệu có thể được hình thành bởi một trong hai
phương pháp mẫn cảm chủ động hoặc thụ động, và cả hai mô hình mẫn cảm có thể xảy
ra bởi quá trình tự nhiên hoặc nhân tạo (hình 1C).
MIỄN DỊCH THỤ ĐỘNG
Miễn dịch có thể thu được mà không cần phải hệ miễn dịch tiếp
xúc với kháng nguyên. Điều này được thực hiện bằng truyền huyết thanh hoặc
gamma-globulin từ một người có miễn dịch sang một cá thể không có miễn dịch.
Ngoài ra, các tế bào miễn dịch từ một cá thể được mẫn cảm có thể được sử dụng để
truyền cho người khác. Miễn dịch thụ động có thể được thực hiện trong tự nhiên
hoặc nhân tạo.
Miễn dịch thụ động tự nhiên
Miễn dịch được chuyển từ mẹ sang thai nhi qua nhau thai (IgG)
hoặc truyền qua sữa non (IgA).
Miễn dịch thụ động nhân tạo
Thông thường miễn dịch được chuyển nhân tạo bằng cách tiêm
kháng thể từ các cá nhân khác hoặc kháng thể từ một động vật miễn dịch.
Truyền miễn dịch thụ động với kháng thể hoặc gamma-globulin được sử dụng
nhiều trong các tình huống cấp tính của bệnh (bạch hầu, uốn ván, sởi, bệnh
dại, vv), ngộ độc (côn trùng, bò sát, bị ngộ độc thịt), và như một biện pháp
dự phòng Trong những tình huống này, kháng thể có nguồn gốc từ con người là
thích hợp hơn, mặc dù kháng thể đặc hiệu sinh ra trong các loài khác có hiệu
quả và được sử dụng trong một số trường hợp (nhiễm độc, bệnh bạch hầu, uốn
ván, hoại thư sinh hơi, ngộ độc). Trong khi hình thức mẫn cảm này có lợi thế
là cung cấp bảo vệ ngay lập tức, kháng thể dị loài có hiệu quả trong một
thời gian ngắn và thường chỉ gây các biến chứng bệnh lý (bệnh huyết thanh)
và sốc phản vệ. Kháng thể đồng loài cũng có nguy cơ truyền bệnh viêm gan và
HIV.
Truyền miễn dịch thụ động của miễn dịch qua trung gian tế
bào cũng có thể được thực hiện trong một số bệnh (ung thư, suy giảm miễn
dịch). Tuy nhiên, rất khó để tìm được người cho hòa hợp mô (hợp nhau) và có
nguy cơ cao đối với căn bệnh chống mảnh ghép của cơ thể chủ.
|
 Hình
1A Hình
1A
Edward Jenner thực hiện một tiêm chủng
 B.
B.
Tỷ lệ mắc bệnh nhiễm trùng phổ biến trước và sau khi tiêm vắcxin
 C.
C.
Mô hình gây mẫn cảm
 D.
D.
Cơ sở của mẫn cảm
 Hình 2
Hình 2
Giới thiệu về chủng đậu
 Hình 3
Hình 3
Vắcxin sống giảm độc lực
 Hình 4
Hình 4
Vắcxin toàn bộ vi sinhvật chết

 Hình
5 Vắcxin mảnh vi khuẩn Hình
5 Vắcxin mảnh vi khuẩn
 Hình 6
Hình 6
Sửa đổi độc tố để thành không độc
 Hình 7
Hình 7
Những ưu điểm và nhược điểm của mẫn cảm thụ động
|
MIỄN DỊCH CHỦ ĐỘNG
Điều này nói đến khả năng miễn dịch
được hình thành bởi cơ thể sau khi tiếp xúc với kháng nguyên.
Miễn dịch chủ động tự
nhiên
Tiếp xúc với các tác nhân gây bệnh khác nhau dẫn
đến nhiễm trùng chưa triệu chứng hoặc có triệu chứng lâm sàng
tạo ra một đáp ứng miễn dịch bảo vệ chống lại các tác nhân gây
bệnh.
Miễn dịch chủ động nhân tạo
Mẫn cảm có thể đạt được bằng cách dùng tác nhân
gây bệnh sống hay đã chết hoặc các thành phần của chúng. Vaccin
được sử dụng để mẫn cảm chủ động bao gồm các vi sinh vật sống (giảm
độc lực), toàn bộ các sinh vật đã chết, các thành phần vi sinh
vật hoặc độc tố được tiết ra (đã được giảm độc lực).
Vắc xin sống
Vaccin sống đầu tiên là virút đậu bò được tạo ra bởi Edward
Jenner như là một thuốc chủng ngừa bệnh đậu mùa (xem phần
vaccin); tuy nhiên, chủng virut đậu mùa (một cải tiến là sử
dụng mủ từ bệnh nhân bị bệnh đậu mùa nhẹ) đã được sử dụng
hơn một ngàn năm (Hình 2)
Vaccin sống được sử dụng để
chống lại một số bệnh nhiễm trùng do virút (bệnh bại
liệt-vaccin Sabin), bệnh sởi, quai bị, rubella, thủy đậu,
viêm gan A, sốt vàng da, vv) (Hình 3). Chỉ có một vaccin vi
khuẩn sống là vaccin chống bệnh lao (Mycobacterium bovis:
Bacille Calmette-Guerin vắc xin: BCG). Nó được sử dụng ở
nhiều nước châu Phi, châu Âu và châu Á nhưng không phải ở
Hoa Kỳ. Trong khi nhiều nghiên cứu đã cho thấy hiệu quả của
vaccin BCG, một số nghiên cứu cũng nghi ngờ về lợi ích của
nó.
Các vaccin sống thuờng được
sản xuất là loại nhiễm trùng không có dấu hiệu lâm sàng và
dẫn đến khả năng miễn dịch, cả miễn dịch dịch thể và miễn
dịch qua trung gian tế bào, về sau nó cần thiết chống lại
tác nhân gây bệnh nội bào. Tuy nhiên, chúng mang một nguy cơ
gây bệnh nghiêm trọng ở những người suy giảm miễn dịch. Hơn
nữa, kể từ khi vaccin sống thường giảm độc lực (làm ít gây
bệnh) bởi chuyển sang động vật hoặc đột biến do nhiệt, chúng
có thể trở lại hình thức gây bệnh và gây bệnh nghiêm trọng.
Vì lý do này mà vaccin sống bại liệt (Sabin) được sử dụng
nhiều năm đã được thay thế ở nhiều nước bởi vaccin bất hoạt
(Salk).
Vaccin chết
Vaccin virut chết (bởi nhiệt, hóa chất hoặc chiếu xạ tia cực
tím) bao gồm các loại vaccin virút của bệnh bại liệt (Salk),
cúm, bệnh dại... Hầu hết các vaccin vi khuẩn bị chết (thương
hàn, tả, dịch hạch, bệnh ho gà,...) (Hình 4).
Vaccin tiểu đơn vị
Một số vaccin chống vi khuẩn có sử dụng các thành phần thành
tế bào được tinh khiết (Haemophilus, ho gà, song cầu, phế
cầu khuẩn,...) (Hình 5). Một số vaccin do virút (viêm gan
B,...) bao gồm các kháng nguyên protein tinh khiết được sản
xuất sau khi biểu lộ tạo dòng một gen vào một vector thích
hợp (ví dụ, nấm men). Khi chất độc gây bệnh của tác nhân
nhiễm trùng sinh ra, thì người ta làm mất tính độc tính
nhưng vẫn còn tính sinh miễn dịch và sử dụng nó như một loại
vaccin (ví dụ như bệnh bạch hầu, uốn ván, tả) (Hình 6).
Những vaccin tiểu đơn vị được thiết kế để giảm thiểu các vấn
đề độc tính. Mỗi loại vaccin có những ưu, nhược điểm riêng (Hình
7).
Vaccin tiểu đơn vị có thể bao gồm các protein hoặc
polysaccharid. Vì polysaccharid là kháng nguyên không phụ
thuộc T nên tương đối yếu, chỉ kích thích sản xuất IgM và
không có trí nhớ miễn dịch. Khi được liên hợp với protein
thì sinh đáp ứng miễn dịch nhiều hơn và là kháng nguyên phụ
thuộc T (ví dụ, Haemophilus, song cầu, phế cầu khuẩn,...).
Các
vaccin mới khác
Một số phương pháp tiếp cận mới với miễn dịch chủ động đang
trong giai đoạn nghiên cứu và chỉ được sử dụng trong thực
nghiệm. Chúng bao gồm các kháng thể kháng idiotyp, vaccin
DNA và peptid trội miễn dịch (được nhận biết bởi các phân tử
MHC) và nhiều loại khác trong tương lai.
-
Kháng thể kháng-idiotyp
chống lại các kháng thể polysaccharid được tạo ra đáp
ứng miễn dịch lâu dài với trí nhớ miễn dịch.
-
Vaccin ADN (các gen
peptid của virút đưa vào vector) phải được tiêm. Chúng
được đưa vào tế bào chủ và sau đó tạo ra một đáp ứng
tương tự như chống lại virút sống giảm độc lực (cả đáp
ứng miễn dịch qua trung gian tế bào và dịch thể). Một số
vaccin DNA chống HIV đã được phát triển nhưng chưa có
loại nào cho thấy hiệu quả nhiều.
-
Peptid trội miễn dịch là
đơn giản và dễ dàng để chuẩn bị và khi kết hợp vào các
MHC có thể gây ra cả đáp ứng miễn dịch dịch thể và qua
trung gian tế bào.
Tá dược
Các kháng nguyên yếu hơn có thể được làm tăng đáp
ứng miễn dịch bằng cách cho thêm các hóa chất khác. Các hóa chất
này được gọi là tá dược. Có nhiều chất sinh học và hóa học đã
được sử dụng trong điều kiện thí nghiệm (Bảng 1). Tuy nhiên, chỉ
có muối nhôm (phèn) được chấp thuận cho sử dụng ở người và nó
được kết hợp trong vaccin DTP. Hơn nữa, bản thân bệnh ho gà có
tác dụng bổ trợ. Tá dược được sử dụng trong thí nghiệm bao gồm
hỗn hợp của dầu và chất tẩy, có (tá dược Freund hoàn chỉnh) hoặc
không có (tá dược Freund không hoàn chỉnh) vi khuẩn nhất định.
Vi khuẩn thường được dùng trong tá dược là mycobacteria (BCG) và
Nocardia. Trong một số trường hợp, các phần phân đoạn tế bào của
các vi khuẩn này cũng có thể được sử dụng hiệu quả như là tá
dược. Các công thức tá dược mới hơn bao gồm các chất cao phân tử
tổng hợp và oligonucleotid. Hầu hết các tá dược nhận biết thụ
thể giống TOLL, do đó hoạt hóa thực bào đơn nhân và sinh ra các
cytokin chọn lọc, có thể tăng cường đáp ứng Th1 hoặc Th2, tùy
thuộc vào bản chất của các tá dược.
|
Bảng 1.
Các tá dược chọn lọc được sử dụng trong thực nghiệm và lâm
sàng |
|
Loại tá dược |
Sử dụng cho người |
Chỉ trong thực nghiệm |
|
Các muối:
Hydroxid nhôm,
Photphat nhôm-photphat canxi
|
Có
Có |
Giải phóng kháng nguyên chậm, tương tác
TLR và cảm ứng cytokin |
|
Beryllium hydroxid
|
Không
|
|
Các hạt tổng hợp:
Liposome, ISCOMs, polylactate
|
Không
|
Giải phóng kháng nguyên chậm |
|
Chuỗi nucleotid:
CpG và yếu tố khác
|
Không* |
Tương tác TLR và cảm
ứng cytokin |
|
Các sản phẩm vi khuẩn:
B.pertussis
|
Có |
Tương tác TLR và cảm ứng
cytokin |
M. bovis
(BCG và loại khác)
|
Không |
Dầu khoáng
|
Không |
Giữ kháng nguyên |
Cytokin:
IL-1, IL-2, IL12, IFN-γ, etc.
|
Không* |
Hoạt hóa và biệt hóa của tế bào T, B và APC |
*Thực
nghiệm dùng cho bệnh ác tính ở người
|
The protective immunity conferred by a vaccine may be
life-long (measles, mumps, rubella, small pox, tuberculosis, yellow
fever, etc.) or may last as little as a few months (cholera). The
primary immunization may be given at the age of 2 to 3 months (diphtheria, pertussis, tetanus,
polio), or 13
to 15
months (mumps, measles, rubella). The currently recommended schedule
for
routine immunization in the United States (recommended by CDC and AIP) is
summarized in Table 2. This schedule is revised on a yearly basis or as
need by the CDC Advisory Committee on Immunization Practice (AICP).
|
Bảng 2 Lịch tiêm chủng chủ
động cho trẻ em bình thường* |
|
Tuổi
Vaccin
|
Sơ sinh |
Tháng |
Tuổi |
|
1 |
2 |
4 |
6 |
12 |
15 |
18 |
19 -23 |
2-3 |
4-6 |
|
Viêm gan B
1 |
HeB |
HeB |
1 |
HeB |
|
|
HeB |
|
Virút Rota 2 |
|
|
Rota |
Rota |
Rota |
|
|
|
|
|
|
Bạch hầu, Uốn ván, Ho gà
3 |
|
|
DTaP |
DTaP |
DTaP |
3 |
DTaP |
|
|
DTaP |
|
Cúm-b (CV) 4 |
|
|
Hib |
Hib |
Hib4 |
Hib |
|
|
Phế cầu 5 |
|
|
PCV |
PCV |
PCV |
PCV |
|
PPV |
Vaccin
chết bại liệt |
|
|
IPV |
IPV |
IPV |
|
|
IPV |
|
Cúm 6 |
|
|
|
|
Influenza (hàng năm) |
|
|
Sởi, Quai bị, Rubella
7 |
|
|
MMR |
|
|
MMR |
MMR |
|
Thủy đậu
8 |
|
|
Var |
|
|
|
|
|
Viêm gan A
9 |
|
|
|
|
|
Hep A (2 liều) |
HepA
series |
|
Não mô cầu
10 |
|
|
|
|
|
|
MCV4 |
|
*Khuyến cáo bởi Ủy ban cố vấn về chủng ngừa, Học viện
nhi khoa Hoa kỳ
|
Khoảng tuổi khuyến cáo |
Nhóm có nguy cơ cao |
CDC
Immunization
schedules |
Miễn dịch bảo vệ do vaccin tạo ra có thể là suốt
đời (sởi, quai bị, rubella, thủy đậu nhỏ, lao, sốt vàng da,...) hoặc có thể kéo
dài ít nhất là vài tháng (dịch tả). Việc tiêm chủng lần đầu
|

Sự bất lợi xảy ra ở 48 giờ của tiêm phòng DPT
|
Mẫn cảm dự phòng so với điều trị
Hầu hết các vaccin được dùng cho dự phòng, nghĩa là trước khi
cơ thể tiếp xúc với mầm bệnh. Tuy nhiên, một số vaccin có thể dùng để điều
trị, tức là sau khi tiếp xúc với mầm bệnh (ví dụ, virút bệnh dại). Hiệu quả
của cách gây mẫn cảm này phụ thuộc vào tốc độ sao chép của các tác nhân gây
bệnh, thời kỳ ủ bệnh và cơ chế gây bệnh. Vì lý do này, chỉ cần có một mũi
tiêm tăng cường với uốn ván là đủ nếu tiếp xúc với tác nhân gây bệnh trong
vòng dưới 10 năm, nếu tiếp xúc là rất nhỏ (vết thương tương đối nông cạn).
Trong một tình huống mà tác nhân gây bệnh có thời gian ủ bệnh ngắn, chỉ một
lượng nhỏ các phân tử gây bệnh có thể gây tử vong (ví dụ, uốn ván và bạch
hầu), vì vậy cả hai loại mẫn cảm thụ động và chủ động là rất cần thiết. Đây
cũng là trường hợp áp dụng cho một ổ nhiễm khuẩn là tương đối lớn.
Mẫn cảm phòng bệnh thụ động cũng áp dụng bình
thường trong các trường hợp khiếm khuyết của hệ thống miễn dịch, như bệnh
không có kháng thể.
Ảnh hưởng có hại của mẫn cảm
Gây miễn dịch chủ động có thể gây sốt, mệt mỏi và khó chịu.
Một số vaccin cũng có thể gây đau khớp hoặc viêm khớp (rubella), co giật,
đôi khi có thể gây tử vong (bệnh ho gà), hoặc rối loạn thần kinh (bệnh cúm).
Dị ứng với trứng có thể phát triển như một hệ quả của vaccin virút được sản
xuất trong trứng (sởi, quai bị, cúm, sốt vàng da). Mẫn cảm lần sau có thể
gây viêm nhiều hơn so với lần đầu. Các tác dụng phụ nghiêm trọng đã được ghi
nhận sau khi sử dụng vaccin DTP (Bảng 3). Hầu hết tác dụng phụ trong số đó
là do các thành phần của vaccin ho gà và đã được loại bỏ bởi việc sử dụng
một vaccin ho gà không tế bào.
|
Bảng 3. Tỷ lệ tương đối các
tác dụng có hại xuất hiện trong vòng 48 giờ sau khi tiêm vaccin DTP |
|
Sự kiện |
Tần suất |
|
Tại chỗ |
| Đỏ, sưng tấy, đau |
1 trong 2-3
liều |
|
Toàn thân trung bình |
| Sốt, uể oải, cáu kỉnh |
1 trong 2-3
liều |
| Nôn, chán ăn |
1 trong 5-15
liều |
|
Toàn thân nặng hơn |
| Khóc liên tục, sốt |
1 trong
100-300 liều |
| Suy sụp, co giật |
1 trong 1750
liều |
| Bệnh não cấp |
1 trong
100,000 liều |
| Suy thần kinh vĩnh viễn |
1 trong
300,000 liều |
|

 Hình
1A
Hình
1A 










