|
x |
x |
|
 |
 |
|
INFEKČNÉ OCHORENIA
|
BACTERIOLÓGIA |
IMUNOLÓGIA |
MYKOLÓGIA |
PARAZITOLÓGIA |
VIROLÓGIA |
|
SLOVAK
|
 |
UNIVERZITA KOMENSKÉHO V
BRATISLAVE
JESSENIOVA LEKÁRSKA FAKULTA V MARTINE
Ústav mikrobiológie a imunológie
Sklabinská 26 , 036 01 Martin
|
 |
IMUNOLÓGIA – KAPITOLA ŠTVRTÁ
IMUNOGLOBULÍNY – ŠTRUKTÚRA A FUNKCIA
Gene Mayer, Ph.D
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Překlad:
Elena
Novakova, MD, PhD
a
MUDr. Martina Neuschlová, PhD.
Institute of
Microbiology and Immunology
Jessenius Faculty of Medicine in Martin
Comenius University in Bratislava
|
|
VIETNAMESE |
|
TURKISH |
|
FRANCAIS |
|
PORTUGUES |
|
SHQIP |
Let us know what you think
SPÄTNÁ VÄZBA |
|
VYHĽADÁVANIE |
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
| CIELE VÝUČBY
Diskutovať o hlavných vlastnostiach všetkých imunoglobulínov
Popísať základnú štruktúru imunoglobulínov
Vzťah štruktúry a funkcie imunoglobulínov
Definovať hypervariabilné a podporné (framework)
oblasti
Definovať triedy a podtriedy imunoglobulínov, typy a
podtypy imunoglobulínov
Popísať štruktúru a vlastnosti jednotlivých tried
imunoglobulínov
 Obrázok 1
Obrázok 1
Elektroforéza bielkovín séra |
DEFINÍCIA
Imunoglobulín (Ig)
Imunoglobulíny sú molekuly glykoproteínov, ktoré sú produkované
plazmatickými bunkami ako odpoveď na imunogén a fungujú ako protilátky.
Názvy imunoglobulínov sú odvodené od zistenia, že pri umiestnení séra s
obsahom protilátok do elektrického poľa, imunoglobulíny migrujú (obrázok
1).
HLAVNÉ FUNKCIE IMUNOGLOBULíNOV
Väzba antigénu
imunoglobulíny sa viažu špecificky k jednému alebo viacerým príbuzným
antigénom. Každý imunoglobulín sa viaže v skutočnosti na špecifický
antigénny determinant (epitop). Schopnosť protilátok viazať antigén je
primárna funkcia protilátok a môže viesť k ochrane hostiteľa. Valencia (väzbovosť)
protilátky súvisí s počtom antigénnych determinant, ktoré jediná
molekula protilátky dokáže naviazať. Valencia u všetkých protilátok je
najmenej dva, ale v niektorých prípadoch je to viac.
Efektorové funkcie
Samotná väzba protilátky s antigénom nemá priamy biologický efekt.
Významné biologické účinky sú dôsledkom sekundárnych „efektorových
funkcií“ protilátok. Imunoglobulíny sprostredkovávajú rad týchto
efektorových funkcií. Schopnosť vykonať určitú funkciu si vyžaduje
predchádzajúce naviazanie antigénu na protilátku. Nie každý
imunoglobulín je schopný sprostredkovať všetky efektorové funkcie.
Efektorové funkcie zajhŕňajú:
-
Fixáciu komplementu – to vedie k jeho aktivácii a k
lýze buniek a zároveň k uvoľneniu biologicky aktívnych molekúl (viď
kapitola 2).
-
Väzba na rôzne druhu imunitných buniek – fagocyty,
lymfocyty, krvné doštičky, mastocyty a bazofily, ktoré majú
receptory, na ktoré viažu imunoglobulíny. Táto väzba môže aktivovať
bunku, aby vykonala určitú funkciu. Niektoré imunoglobulíny sa tiež
viažu na receptory placentárneho trofoblastu, čo má za následok
prenos imunoglobulínov cez placentu. Výsledkom je prenos materských
protilátok a ochrana plodu a novorodenca.
|
|
Kľúčové slová
Imunoglobulín
Valencia
Ťažký reťazec
Ľahký reťazec
Variabilná oblasť
Podporná (framework) oblasť
Pántová oblasť
Domény
Hypervariabilné oblasti
podporné (framevork) oblasti
Skupiny a podskupiny
Fab a Fc, F(ab')2
Typ a podtyp
Trieda a podtrieda
Opsonín
J reťazec
Sekrečná zložka
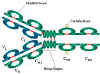 Obrázok
2A Obrázok
2A
Základná štruktúra imunoglobulínov
 Obrázok
2B Obrázok
2B
Kliknite na obrázok vľavo na otvorenie animovaného tutoriálu o štruktúre
protilátok. Dostupné Chime Plug-In. Ísť na Chime tu.
Developed by Eric Martz. Development supported by the Division of
Undergraduate Education of the National Science Foundation.
 Obrázok 2C Nákres protilátky IgG2A.
Obrázok 2C Nákres protilátky IgG2A.
Harris, L. J., Larson, S. B., Hasel, K.
W., Day, J., Greenwood, A., McPherson, A. Nature 1992, 360, 369-372. ©
2000 Antibody Resource Page
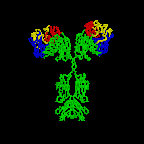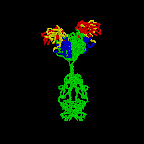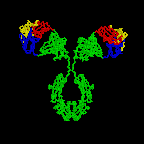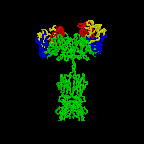 Obrázok 2D
Obrázok 2D
Rotujúca protilátka
Jose Saldanha, Humanization by Design © 2000, Antibody
Resource Page
|
ZÁKLADNÁ ŠTRUKTÚRA
IMUNOGLOBULÍNOV
Základná štruktúra imunoglobulínov je znázornená na obrázku
2. Aj keď sa môžu rôzne imunoglobulíny líšiť štruktúrou, všetky sú
vybudované z rovnakých základných jednotiek.
Ťažké a ľahké
reťazce
Všetky imunoglobulíny majú štyri reťazce ako svoje základné jednotky.
Skladajú sa z dvoch identických ľahkých reťazcov (23 kD) a dvoch
identických ťažkých reťazcov (50-70 kD).
Disulfidické väzby
Disulfidické väzby medzi
reťazcami
Ťažké a ľahké reťazce a dva ťažké reťazce sú navzájom držané
pohromade disulfidickými väzbami medzi reťazcami a nekovalentnými
interakciami. Počet disulfidických väzieb medzi reťazcami sa líši
medzi jednotlivými imunoglobulínovými molekulami.
Disulfidické väzby v rámci
reťazca
V každom polypeptidovom reťazci existujú tiež disulfidické väzby vo
vnútri reťazca.
Variabilné (V) a
konštantné (C) oblasti
Keď sa porovnávali aminokyselinové sekvencie mnohých odlišných ťažkých a
ľahkých reťazcov, ukázalo sa, že ako ťažký tak aj ľahký reťazec môžu byť
rozdelené do dvoch oblastí na základe variability v aminokyselinových
sekvenciách. Sú to:
Ľahký reťazec – VL (110 aminokyselín) a CL (110
aminokyselín)
Ťažký reťazec – VH (110 aminokyselín) a CH (330 -
440 aminokyselín)
Pántová oblasť
Ide o oblasť, v ktorej ramená molekuly protilátky vytvárajú tvar písmena
Y. Nazýva sa pántová oblasť, pretože v tomto bode existuje určitá
flexibilita v molekule.
Domény
trojrozmerné obrazy imunoglobulínovej molekuly ukazujú, že nie je rovná,
ako je znázornené na obrázku 2A. Skôr je zložená do guľovitých oblasti,
z kotrých každá obsahje disulfidické bäzby vo vnútri reťazca (obrázok 2B
– D). Tieto oblasti sa nazývajú domény.
Ľahký reťazec domény – VL a CL
Ťažký reťazec domény – VH a CH1-3 (alebo CH4).
Oligosacharidy
Uhľovodíky sú pripojené u väčšiny imunoglobulínov k CH2 doméne. Avšak v
niektorých prípadoch môžu byť pripojené aj na iných miestach.
ŠTRUKTÚRA VIARABILNEJ OBLASTI
Hypervariabilné (HVR)
alebo komplementaritu determinujúce úseky (CDR)
Porovnania sekvencií aminokyselín vo variabilných oblastiach
imunoglobulínov ukazujú, že väčšina sa nachádza v troch oblastiach
nazývaných hypervariabilné úseky alebo úseky určujúce komplementaritu,
ako je zobrazené na obrázku 3. Protilátky s odlišnou špecificitou (odlišné
väzbové miesta) majú odlišné komplementaritu determinujúce úseky.
Protilátky s úplne rovnakou špecificitou majú zhodné komplementaritu
určujúce úseky (t.j. CDR je väzbové miesto protilátky). Komplementaritu
determinujúce úseky sa nachádzajú aj na ťažkých H reťazcoch aj na
ľahkých L reťazcoch.
Podporné
(framework) úseky
Úseky medzi komplementaritu determinujúcimi úsekmi vo variabilnej časti
sa nazývajú podporné (framework) úseky (obrázok 3). Na základe
podobností a rozdielov v podporných úsekoch môžu byť variabilné oblasti
ťažkých a ľahkých reťazcov imunglobulínov rozdelené do skupín a
podskupín. Sú produktami odlišných génov pre variabilné oblasti.
|
 Obrázok 3 Štruktúra podporných (framework) úsekov
Obrázok 3 Štruktúra podporných (framework) úsekov
|
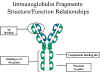
FRAGMENTY IMUNOGLOBULÍNOV: ŠTRUKTÚRA
/ FUNKČNÉ VZŤAHY Fragmenty imunoglobulínov vytvorené
proteolytickým štiepením sa ukázali ako veľmi dôležité pri objasnení
štruktúry a funkčných vzťahov imunoglobulínov.
Fab
Papaínom sa rozštiepi imunoglobulín v pántovej oblasti pred
disulfidovou väzbou spájajúcou ťažké reťazce (obrázok 4). To vedie k
vytvoreniu dvoch identických fragmentov, ktoré obsahujú ľahký
reťazec a VH aCH1 domény ťažkého reťazca.
Väzba antigénu: Tieto fragmenty sa nazývajú Fab fragmenty,
pretože obsahujú väzbové miesta protilátky. Každý Fab fragment
je monovalentný (jednoväzbový), zatiaľ čo pôvodná molekula je
divalentná (dvojväzbová). Väzbové miesto protilátky je tvorené
VH a VL doménami. Protilátka je schopná viazať určitý antigénny
determinant, pretože má určitú kombináciu VH a VL domén. Rôzne
kombinácie VH a VL vedú k existencii protilátok, ktoré majú
schopnosť viazať rozličné antigénne determinanty.
Fc
Štiepenie papaínom tiež umožňuje vznik fragmentu, ktorý obsahuje
zvyšok dvoch ťažkých reťazcov. Každý z nich obsahuje CH2 a CH3
doménu. Tento fragment sa nazýva Fc, pretože ľahko kryštalizuje (F
crystallized).
|
 Obrázok 4
Obrázok 4
Fragmenty imunoglobulínu: vzťah medzi štruktúrou a funkciou |
Efektorové funkcie: efektorové funkcie imunoglobulínov sú
zabezpečené Fc časťou molekuly imunoglobulínu. Rozličné domény tohto
fragmentu sprostredkúvajú rozličné funkcie (obrázok 5). Za
normálnych okolností je na vykonanie efektorových funkcií protilátky
potrebná väzba protilátky s antigénom (až na výnimky).
|
 Obrázok 5
Obrázok 5
Fragmenty imunoglobulínu: vzťah medzi štruktúrou a funkciou |
F(ab')2
Pepsínom je možné rozštiepiť imunoglobulín v oblasti za disulfidovou
väzbou spájajúcou ťažké reťazce. To vedie ku vzniku fragmentu, ktorý
bude obsahovať obidve väzbové miesta pre anitgén (obrázok 6). Tento
fragment sa nazýva F(ab´)2, pretože je divalentný (dvojväzbový). Fc
oblasť molekuly imunoglobulínu sa rozštiepi pepsínom na malé peptidy.
F(ab´)2 síce viaže antigénne determinanty, ale efektorové funkcie
protilátky nie sú sprostredkované.
|
 Obrázok 6
Obrázok 6
Fragmenty imunoglobulínu: vzťah medzi štruktúrou a funkciou |
ĽUDSKÝ IMUNOGLOBULÍN –
TRIEDY, PODTRIEDY, TYPY A PODTYPY
Triedy
imunoglobulínov
Imunoglobulíny sú rozdelené do piatich tried, a to na základe rozdielov
v sekvenciách aminokyselín v konštantnej oblasti ťažkých reťazcov.
Všetky imunoglobulíny v rámci určitej triedy budú mať veľmi podobné
konštantné oblasti ťažkého reťazca. Tieto rozdiely môžu byť zistené
sekvenčnými štúdiami alebo častejšie sérologickými metódami.
-
IgG - Gamma ťažké reťazce
-
IgM – Mí ťažké reťazce
-
IgA - Alfa ťažké reťazce
-
IgD - Delta ťažké reťazce
-
IgE - Epsilon ťažké reťazce
Podtriedy imunoglobulínov
Triedy imunoglobulínov sa rozdeľujú na podtriedy na základe malých
rozdielov v aminokyselinových sekvenciách v konštantnej oblasti ťažkých
reťazcov. Všetky imunoglobulíny v podtriede budú mať veľmi podobné
aminokyselinové sekvencie konštantnej oblasti ťažkého reťazca. Tieto
rozdiely sú najčastejšie detegovateľné sérologickými metódami.
-
IgG1 - Gamma 1 ťažké reťazce
-
IgG2 - Gamma 2 ťažké reťazce
-
IgG3 - Gamma 3 ťažké reťazce
-
IgG4 - Gamma 4 ťažké reťazce
|
| |
Imunoglobulínové typy
Imunoglobulíny môžu byť rozdelené podľa typu ľahkého reťazca, ktorý majú.
Typy ľahkého reťazca sú dané rozdielmi v sekvencii aminokyselín v
konštantnej oblasti ľahkého reťazca.
Kappa ľahké reťazce
Lambda ľahké reťazce
Podtypy
imunoglobulínov
Ľahké reťazce môžu byť rozdelené na podtypy podľa rozdielov v sekvencii
aminokyselín v konštantnej oblasti ľahkého reťazca.
Lambda subtypy
-
Lambda 1
-
Lambda 2
-
Lambda 3
-
Lambda 4
Názvoslovie
Imunoglobulíny sú pomenované podľa triedy alebo podtriedy ťažkého reťazca a
typu alebo subtypu ľahkého reťazca. Ak nie je presne uvedené, predpokladá sa,
že sú prítomné všetky podtriedy, typy a podtypy. Napríklad IgG znamená, že
sú prítomné všetky podtriedy a typy.
Rôznorodosť
Imunoglobulíny sú považované za veľmi heterogénnu populáciu molekúl, pretože
obsahujú rôzne triedy a podtriedy, z ktorých každá ma rôzne typy a podtypy
ľahkých reťazcov. Navyše rôzne molekuly imunoglobulínov môžu viazať rôzne
antigény, lebo majú rôzne oblasti VH a VL.
|
 Obrázok 7
Obrázok 7
Štruktúra IgG |
ŠTRUKTÚRA A NIEKTORÉ VLASTNOSTI
TRIED A PODTRIED IMUNOGLOBULÍNOV
IgG
Štruktúra
Štruktúra podtried imunoglobulínov IgG je uvedená na obrázku 7.
Všetky IgG sú monoméry. Podtriedy sa líšia v počte disulfidových
väzieb a v dĺžke pantovej oblasti.
Vlastnosti
IgG je najuniverzálnejší imunoglobulín, pretože je schopný vykonávať
všetky funkcie imunoglobulínových molekúl.
- IgG je hlavný imunoglobulín v sére - 75% sérových Ig je IgG
- IgG je hlavný Ig v extravaskulárnom priestore
- Placentárny prenos - IgG je jediná trieda Ig, ktorá
prechádza placentou. Prenos je sprostredkovaný receptorom na
placentárnych bunkách pre Fc oblasť IgG. Nie všetky podtriedy
prechádzajú rovnako dobre (IgG2 neprechádza dobre
- Fixuje komplement – nie všetky podtriedy fixujú komplement
rovnako dobre; IgG4 nefixuje komplement
- Väzba na bunky – makrofágy, monocyty, PMNL a niektoré
lymfocyty majú Fc receptory pre Fc oblasť IgG. Nie všetky
podtriedy sa viažu rovnako dobre; IgG2 a IgG4 sa neviažu na Fc
receptory. Dôsledkom väzby na receptory Fc na PMNL, monocytoch a
makrofágoch je to, že bunka môže lepšie pohltiť antigén.
Protilátka pripravila antigén fagocytujúcim bunkám na ľahšie
pohltenie. Termín opsonín sa používa na označenie látok, ktoré
uľahčujú fagocytózu. IgG je dobrý opsonín. Väzba IgG na Fc
receptory na iných typoch buniek vedie k aktivácii ďalších
funkcií.
|
 Obrázok 8
Obrázok 8
Štruktúra sérového IgM - pentamér
 Obrázok
9 Obrázok
9
Štruktúra IgM na povrchu bunky
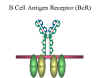 Obrázok 10
Obrázok 10
Receptor B buniek (BCR) |
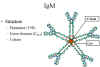
IgM
Štruktúra
Štruktúra IgM je zobrazená na obrázku 8. IgM existuje vo forme
pentaméru (19S imunoglobulín), ale môže sa vyskytovať aj ako monomér.
Vo forme pentaméru má všetky ťažké reťazce identické a identické sú
aj všetky ľahké reťazce. Valencia je teoreticky 10. IgM má ďalšiu
doménu na μ reťazci (doménu CH4) a ďalší proteín viazaný S-S väzbou
a nazvaný J reťazec. Tento reťazec zohráva funkciu pri polymerizácii
molekuly na pentamér.
Vlastnosti
-
IgM je tretí najčastejší sérový Ig.
-
IgM je prvý Ig, ktorý si vytvára plod a prvý Ig,
ktorý tvoria B lymfocyty stimulované antigénom.
-
V dôsledku štruktúry pentaméru, IgM dobre
aktivuje komplement. Protilátky IgM teda veľmi účinne vedú k
lýze mikroorganizmov.
-
V dôsledku svojej štruktúry je IgM tiež dobrým
aglutinačným imunoglobulínom. IgM sú tiež účinné pri zhlukovaní
mikroorganizmov pre ich eventuálnu elimináciu z tela.
-
IgM sa viaže na niektoré bunky prostredníctovm
Fc receptorov.
-
Tvorí receptor na B lymfocytoch. Povrchový IgM
existuje ako monomér a nemá J reťazec, ale na C-konci má ďalších
20 aminokyselín na svoje ukotvenie do membrány B lymfocytu (obrázok
9). IgM na povrchu B lymfocytu funguje ako receptor pre antigén.
Povrchový IgM je nekovalentne viazaný s ďalšími dvoma proteínmi
v membráne B lymfocytu, ktoré sa označujú Ig-alfa a Ig-beta, ako
je zobrazené na obrázku 10. Tieto proteíny pracujú ako molekuly
prenášajúce signál do vnútra bunky, pretože cytoplazmatický
koniec samotného IgM je príliš krátky na prenos signálu. Na to,
aby bol signál prenesený reťazcami Ig-alfa a Ig-beta musí nastať
kontakt medzi povrchovým imunoglobulínom a antigénom. V prípade
T-nezávislých antigénov je kontakt medzi antigénom a povrchovým
imunoglobulínom na B lymfocytoch dostatočný na aktiváciu B
lymfocytov a ich diferenciáciu na plazmatické bunky produkujúce
protilátky. V prípade T-závislých antigénov je potrebný druhý
signál, ten poskytujú pomocné Th lymfocyty pred aktiváciou B
lymfocytov.
|

Obrázok 11
IgA štruktúra

Obrázok 12
Vznik sekrečného IgA |
IgA
Štruktúra
Sérový imunoglobulín IgA je monomér, ale IgA vyskytujúci sa v
sekrétoch je dimér, ako je zobrazené na obrázku 11. Ak sa IgA
nachádza vo forme diméru, obsahuje J reťazec.
Ak sa IgA vyskytuje v sekrétoch, má aj ďalší proteín, čo sa označuje
ako sekrečná časť alebo T časť; sIgA sa niekedy označuje ako
imunoglobulín 11S. Narozdiel od zvyšku IgA, ktorý sa tvorí v
plazmatickej bunke, sekrečná časť sa tvorí v epitelových bunkách a
pridaná je k IgA, keď prechádza do sekrétov (obrázok 12). Sekrečná
časť pomáha IgA pri transporte IgA cez sliznicu a tiež ho chráni
pred degradáciou v sekrétoch.
Vlastnosti
- IgA je druhý najčastejšie zastúpený sérový Ig
- IgA je hlavný Ig v sekrétoch – slzy, sliny, kolostrum,
sliznice. Vzhľadom na to, že sa nachádza v sekrétoch, sekrécia
IgA je dôležitá v lokálnej (slizničnej) imunite.
- IgA nefixuje komplement, pokiaľ nie je agregovaný.
- IgA sa môže viazať na niektoré bunky – PMNL a niektoré
lymfocyty.
|
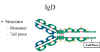 Obrázok 13
Obrázok 13
IgD štruktúra |
IgD
Štruktúra
Štruktúra IgD je zobrazená na obrázku 13. IgD sa vyskytuje iba vo
forme monoméru.
Vlastnosti
-
IgD sa nachádza v nízkych hladinách v sére; jeho
úloha v sére je nejasná.
-
IgD sa nachádza na povrchu B lymfocytov, kde
pôsobí ako receptor pre antigén. IgD na povrchu B lymfocytov má
na C-konci extra animokyseliny na ukotvenie do membrány. Tiež sa
spája s reťazcami Ig-alfa a Ig-beta.
-
IgD nefixuje komplement.
|
 Obrázok 14
Obrázok 14
IgE štruktúra |
IgE
Štruktúra
Štruktúra IgE je zobrazená na obrázku 14. IgE sa vyskytuje vo forme
monoméru a má extra doménu v konštantnej oblasti.
Vlastnosti
-
IgE je najmenej zastúpený sérový Ig, pretože sa
viaže na Fc receptory na bazofiloch a mastocytoch ešte pred
interakciou s antigénom
-
Zúčastňuje sa na alergických reakciách – v
dôsledku väzby na bazofily a mastocyty sa IgE podieľa na
alergických reakciách. Väzba alergénu na IgE na bunkách vedie k
uvoľneniu rôznych mediátorov, ktoré vedú k alergickým prejavom.
-
IgE hrá tiež úlohu v parazitárnych ochoreniach
spôsobených helmintami. Keďže sérové hladiny IgE pri
parazitárnych ochoreniach vzrastajú, meranie hladín IgE je
užitočné pri diagnostike parazitárnych infekcií. Eozinofily majú
Fc receptory pre IgE a väzba eozinofilov na helminty pokryté IgE
vedie k usmrteniu parazita.
-
IgE nefixuje komplement.
|
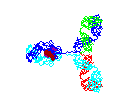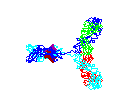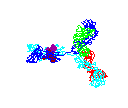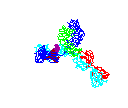 Obrázok
15 Obrázok
15
Rotácia protilátky
© 2000 Zdroj protilátok Koncepcia protilátok |
KLINICKÝ DOSAH TRIED ĽUDSKÝCH
IMUNOGLOBULÍNOV
Adapted from:F.T. Fischbach in "A Manual of Laboratory Diagnostic Tests,"
Ed., J.B. Lippincott Co., Philadelphia, PA
IgG
Zvýšenie:
- Chronické granulomatózne infekcie
- Infekcie všetkých typov
- Hyperimunizácia
- Ochorenia pečene
- Malnutrícia (ťažká)
- Dysproteinémia
- Ochorenia spojené s hypersenzitívnymi granulómami,
dermatologickými poruchami a IgG myelómom
- Reumatoidná artritída
Zníženie:
- Agamaglobulinémia
- Lymfoidná aplázia
- Selektívna IgG, IgA deficiencia
- IgA myelóm
- Bence Jones proteinémia
- Chronická lymfoblastická leukémia
IgM
Zvýšenie (u dospelých):
- Waldenströmova makroglobulinémia
- Trypanozomiáza
- Aktinomykóza
- Carriónova choroba (bartonelóza)
- Malária
- Infekčná mononukleóza
- Lupus erythematosus
- Reumatoidná artritída
- Dysgamaglobulinémia (niektoré prípady)
Poznámka: U novorodencov je hladina IgM nad 20 nanogram/deciliter
indikáciou in utero stimulácie imunitného systému a stimulácie vírusom
rubeoly, cytomegalovírusom, syfilisom alebo toxoplazmózou.
Zníženie:
- Agamaglobulinémia
- Lymfoproliferatívne ochorenia (určité prípady)
- Lymfatická aplázia
- IgG a IgA myelómy
- Dysgamaglobulinémia
- Chronická lymfoblastická leukémia
IgA
Zvýšenie:
- Wiskott-Aldrich syndróm
- Cirhóza pečene (väčšina prípadov)
- Niektoré štádiá kolagenóz a iné autoimunitné choroby, ako
napríklad reumatoidná artritída a lupus eryhematosus
- Chronické infekcie, ktoré nie sú v súvislosti s imunodeficitmi
- IgA myelóm
Zníženie:
- Dedičná ataxia telangiectasis
- Imunodeficitné stavy (napr. dysgamaglobulinémia, vrodená a
získaná agamaglobulinémia a hypogamaglobulinémia)
- Malabsorbčný syndróm
- Lymfoidná aplázia
- IgG myelóm
- Akútna lymfoblastická leukémia
- Chronická lymfoblastická leukémia
IgD
Zvýšenie:
- Chronické infekcie
- IgD myelómy
IgE
Zvýšenie:
- Atopické kožné choroby ako napr. ekzémy
- Senná nádcha
- Astma
- Anafylaktický šok
- IgE myelóm
Zníženie:
- Vrodená agamaglobulinémia
- Hypogamaglobulinémia spôsobená poruchou metabolizmu alebo
syntézy imunoglobulínov
|
|

 |
 Return to the Immunology Section of Microbiology and Immunology On-line
Return to the Immunology Section of Microbiology and Immunology On-line
This page last changed on
Sunday, December 10, 2017
Page maintained by
Richard Hunt
|

 Obrázok 3 Štruktúra podporných (framework) úsekov
Obrázok 3 Štruktúra podporných (framework) úsekov Obrázok 4
Obrázok 4 Obrázok 5
Obrázok 5 Obrázok 6
Obrázok 6 Obrázok 7
Obrázok 7 Obrázok 8
Obrázok 8
 Obrázok 13
Obrázok 13 Obrázok 14
Obrázok 14 Obrázok
15
Obrázok
15 




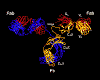
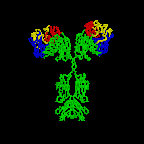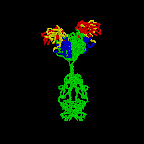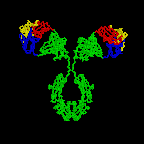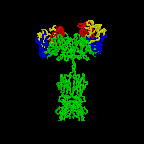 Obrázok 2D
Obrázok 2D

