|
x |
x |
|
 |
 |
|
INFEKČNÉ OCHORENIA
|
BACTERIOLÓGIA |
IMUNOLÓGIA |
MYKOLÓGIA |
PARAZITOLÓGIA |
VIROLÓGIA |
|
ENGLISH |
 |
UNIVERZITA KOMENSKÉHO V
BRATISLAVE
JESSENIOVA LEKÁRSKA FAKULTA V MARTINE
Ústav mikrobiológie a imunológie
Sklabinská 26 , 036 01 Martin
|
 |
IMUNOLÓGIA – KAPITOLA DRUHÁ
KOMPLEMENT
Gene Mayer, Ph.D
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Překlad:
Elena
Novakova, MD, PhD
a
MUDr. Martina Neuschlová, PhD.
Institute of
Microbiology and Immunology
Jessenius Faculty of Medicine in Martin
Comenius University in Bratislava
|
|
VIETNAMESE |
|
TURKISH |
|
FRANCAIS |
|
SHQIP |
|
ESPANOL |
|
PORTUGUES |
|
Let us know what you think
SPÄTNÁ VÄZBA |
|
VYHĽADÁVANIE |
|
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
|
|
CIELE VÝUČBY
Poznať rôzne cesty aktivácie komplementu
Poznať enzymatické a neenzymatické mechanizmy
aktivácie komplementu
Poznať biologické vlastnosti produktov aktivácie
komplementu
Poznať význam komplementového systému v
obranyschopnosti hostiteľa, zápale a poškodení vlastného
Pochopiť mechanizmy regulácie komplementu a jeho produktov
 Jules Bordet (1870-1961), objaviteľ komplementu
Jules Bordet (1870-1961), objaviteľ komplementu
National Library of Medicine
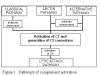 Obrázok 1
Obrázok 1
Cesty aktivácie komplementu
|
FUNKCIE KOMPLEMENTU
Historicky sa termín komplement (C) používal na označenie tepelne labilnej
zložky séra, ktorá bola schopná lyzovať baktérie (inaktivovaný bol zahrievaním
séra pri teplote 56⁰C počas 30 minút). Je však známe, že komplement prispieva k
obrane hostiteľa aj inými spôsobmi. Komplement môže opsonizovať baktérie, a tým
zvýšiť fagocytózu. Môže priťahovať a aktivovať rôzne bunky vrátane
polymorfonukleárnych buniek (PMNL) a makrofágov. Môže sa podieľať na regulácii
protilátkových odpovedí a môže pomôcť pri odstraňovaní imunokomplexov a
apoptotických buniek. Komplement tiež môže mať škodlivé účinky na organizmus
hostiteľa, prispieva k zápalovému poškodeniu tkaniva a môže vyvolať anafylaxiu.
Komplement obsahuje viac ako 20 rôznych sérových proteínov (pozri tabuľku 1),
ktoré sú produkované rozličnými bunkami, najmä hepatocytmi, makrofágmi a
epitelovými bunkami čreva. Niektoré proteíny komplementu sa viažu na
imunoglobulíny alebo membrány buniek. Iné fungujú ako proenzýmy, ktoré po
aktivácii štiepia jeden alebo viac ďalších zložiek komplementu. Po rozštiepení
niektorých zložiek komplementu vzniknú fragmenty, ktoré aktivujú bunky, zvyšujú
vaskulárnu permeabilitu alebo opsonizujú baktérie a majú mnoho iných
biologických funkcií
|
Tabuľka 1
Proteíny komplementového systému
|
|
Klasická cesta |
Lektínová cesta |
Alternatívna cesta |
Lytická cesta |
|
Aktivačné proteíny:
C1qrs, C2, C3, C4
Kontrolné proteíny:
C1-INH, C4-BP
|
Manózu viažuci proteín (MBP), s manózou asociovaná serínová proteáza (MASP,
MASP2) |
C3, Factory B & D*, Properdin
(P)
Factory I* & H, rozpadový akceleračný faktor (DAF),
komplementový receptor 1(CR1), etc. |
C5, C6, C7, C8, C9
Protein S |
|
Zložky podčiarknuté získajú po aktivácii enzymatickú aktivitu
Zložky, ktoré sú označené hviezdičkou majú enzymatickú aktivitu v ich pôvodnej
forme
|
|
| |
CESTY AKTIVÁCIE
KOMPLEMENTU
Aktivácia komplementu môže byť uskutočnená jednou z týchto ciest (obrázok 1):
klasická cesta, lektínová cesta, alternatívna cesta a tvorba membránového
útočného komplexu (alebo lytická). Klasická a alternatívna cesta vedú k tvorbe
C5 konvertázy a produkcii C5b fragmentu, ktorý je nevyhnutný pre vytvorenie
membránového útočného komplexu.
|
|
|
|
|
Klasická cesta (Obrázok 2)
C1
aktivácia
C1, je proteín, ktorý obsahuje tri odlišné proteíny (C1q, C1r a C1s),
viaže sa na Fc oblasť imunoglobulínov IgG a IgM, ktoré reagovali s
antigénom. Väzba C1 sa neuskutoční, ak nie je vytvorený komplex
antigén-protilátka. Väzba si vyžaduje ióny vápnika a horčíka. Väzba C1
na protilátku sa uskutočňuje cez C1q a C1q musí prekrížiť aspoň dve
molekuly protilátok predtým, ako sa väzba pevne fixuje. Väzba C1q vedie
k aktivácii C1r a to následne aktivuje C1s. Výsledkom je vytvorenie
aktivovaného „C1qrs“, čo je enzým, ktorý štiepi C4 na C4a C4b.
C4 a
C2 aktivácia (tvorba C3 konvertázy)
C4b fragment sa viaže na membránu a C4a fragment sa uvoľňuje do
mikroprostredia. Aktivované „C1qrs“ tiež štiepi C2 zložku na C2a a C2b.
C2a sa viaže na membránu a spája sa s C4b, C2b sa uvoľňuje do
mikroprostredia. Výsledný komplex C4b2a je C3 konvertáza, ktorá štiepi
C3 na C3a a C3b.
C3
aktivácia (tvorba C5 konvertázy)
C3b sa viaže na membránu a spája sa s C4b a C2a, C3a fragment sa
uvoľňuje do mikroprostredia. Vzniknutý C4b2a3b je C5 konvertáza. Tvorba
C5 konvertázy je koncom klasickej cesty.
Niektoré produkty klasickej cesty majú silné biologické účinky, ktoré
prispievajú k obranyschopnosti hostiteľa. Niektoré z týchto produktov
môžu mať škodlivé účinky aj vted, keď sa tvoria nekontrolované. Tabuľka
2 sumarizuje biologické aktivity zložiek klasickej cesty.
|
Tabuľka 2
Biologické účinky produktov klasickej cesty |
Komponent
(zložka) |
Biologický účinok |
| C2b |
Prokinín; štiepený plazmínom za
vzniku kinínu, čo vedie k vzniku edému |
| C3a |
Anafylotoxín; môže aktivovať
bazofily a mastocyty k degranulácii a uvoľneniu vazoaktívnych látok,
čo vedie k zvýšeniu vaskulárnej permeability a ku kontrakcii hladkej
svaloviny. Môže to viesť k vzniku anafylaxie. |
| C3b |
Opsonín; podporuje fagocytózu väzbou na
komplementové receptory
Aktivuje bunky fagocytózy |
| C4a |
Anafylatoxín (slabší ako C3a) |
| C4b |
Opsonín; promotes phagocytosis by
binding to complement receptors |
Ak by klasická cesta nebola regulovaná, pokračovala by tvorba C2b, C3a
aj C4a. Preto musí existovať spôsob, ako regulovať činnosť klasickej
cesty. Tabuľka 3 sumarizuje spôsoby regulácie klasickej cesty.
|
Tabuľka 3
Regulácia klasickej cesty |
| Komponent |
Regulácia |
| Všetky |
C1-INH; odpája C1r a C1s od C1q |
| C3a |
C3a inhibítor
(C3a-INA;karboxypeptidáza B); inaktivuje C3a |
| C3b |
Faktory H a I; Faktor H uľahčuje
degradáciu C3b faktorom I |
| C4a |
C3-INA |
| C4b |
C4 viažuci proteín(C4-BP) a Faktor
I; C4-BP uľahčuje degradáciu C4b faktorom I; C4-BP tiež bráni
spojeniu C2a s C4b, čím blokuje tvorbu C3 konvertázy |
Význam C1-INH pri regulácii klasickej cesty je dokázaná vznikom
ochorenia, ktoré je následkom deficitu tohto inhibítora. Spája sa s
vývojom hereditárneho angioedému.
|
 A. Tvorba C3 konvertázy pri klasickej ceste
A. Tvorba C3 konvertázy pri klasickej ceste
 B Tvorba C5 konvertázy pri klasickej ceste
B Tvorba C5 konvertázy pri klasickej ceste
 C Aktivácia C3 klasickou cestou
C Aktivácia C3 klasickou cestou
Obrázok 2
|
 Obrázok 3 Lektínová cesta
Obrázok 3 Lektínová cesta |
Lektínová cesta
Lektínová cesta (obrázok 3) je veľmi podobná klasickej ceste. Začína
sa väzbou manózu viažuceho lektínu (MBL) na bakteriálne povrchy s
polysacharidmi obsahujúcimi manózu (manany). Väzba MBL na patogén má za
následok asociáciu dvoch serínových proteáz MASP-1 a MASP-2 (to sú
serínové proteázy asociované s MBL). MASP-1 a MASP-2 sú obdobou C1r a
C1s a MBL je obdobou C1q. Vytvorením komplexu MBL/MASP-1/MASP-2 dôjde k
aktivácii MASP a následnému štiepeniu C4 na C4a a C4b. fragment C4b sa
viaže na membránu a fragment C4a sa uvoľňuje do mikroprostredia.
Aktivované MASP tiež štiepia C2 na C2a a C2b. Fragment C2a sa viaže na
membránu a spája sa s C4b. Fragment C2b sa uvoľňuje do mikroprostredia.
Výsledný komplex C4bC2a je C3 konvertáza, ktorá štiepi C3 na C3a a C3b.
Fragment C3b sa viaže na membránu a spája sa s C4b a C2a. Fragment C3a
sa uvoľňuje do mikroprostredia. Výsledný C4bC2aC3b je C5 konvertáza.
Vytvorením C5 konvertázy sa končí časť lektínovej cesty.
Biologické aktivity a regulačné proteíny lektínovej cesty sú rovnaké
ako v klasickej ceste.
|
 Obrázok
4 Obrázok
4
Spontánna aktivácia C3
|
Alternatívna cesta
Alternatívna cesta začína aktiváciou C3 a vyžaduje faktory B a D a Mg2+
katióny, všetky sa normálne nachádzajú v sére.
Amplifikačná slučka pri
tvorbe C3b (obrázok 4)
V sére dochádza v malej miere k spontánnej hydrolýze C3 a k tvorbe
C3i. Faktor B sa viaže na C3i a stáva sa citlivý na faktor D, ktorý
potom štiepi faktor B na Bb. Komplex C3iBb pracuje ako C3 konvertáza
a štiepi C3 na C3a a C3b. Akonáhle vznikne fragment C3b, naviaže sa
naň faktor B a stáva sa náchylný na štiepenie faktorom D. Výsledný
komplex C3bBb je C3 konvertáza, ktorá bude generovať ďalšie C3b, čím
sa amplifikuje produkcia C3b. Ak by sa tento proces nekontroloval,
výsledkom by bolo spotrebovanie všetkého C3 v sére. Spontánna
produkcia C3b je teda prísne kontrolovaná.
|

 Obrázok 5
Obrázok 5
Regulácia aktivácie C3 prostredníctvom DAF
 Obrázok
6 Regulácia aktivovaného C3 prostredníctvom CR1 Obrázok
6 Regulácia aktivovaného C3 prostredníctvom CR1
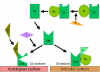 Obrázok
7 Stabilizácia C3 konvertázy Obrázok
7 Stabilizácia C3 konvertázy
 Obrázok 8
Obrázok 8
Stabilizácia C5 konvertázy alternatívnej cesty
|
Kontrola amplifikačnej
slučky (obrázky 5 a 6)
Pri spontánnej produkcii C3b sa viaže tento fragment na autológne
hostiteľské membrány, interaguje s faktorom urýchľujúcim rozklad (DAF),
ktorý blokuje asociáciu faktora B s C3b, čím bráni tvorbe ďalšej C3
konvertázy. Okrem toho DAF urýchľuje odštiepenie Bb z C3b z už
vytvorenej C3 konvertázy, čím sa zastaví tvorba ďalšieho C3b.
Niektoré bunky majú komplementový receptor 1 (CR1). Väzba C3b na
receptor CR1 usľahčuje enzymatickú degradáciu C3b faktorom I. Okrem
toho viazanie C3 konvertázy (C3bBb) na CR1 tiež odštiepi Bb od
komplexu. Takže v bunkách, ktoré majú komplementárne receptory, hrá
tiež CR1 úlohu v riadení amplifikačnej slučky. Nakoniec faktor H sa
môže viazať na fragment C3b a môže uľahčiť enzymatickú degradáciu
C3b faktorom I. Amplifikačná slučka je teda riadená buď blokovaním
tvorby C3 konvertázy, štiepením C3 konvertázy alebo enzymatickým
štiepením C3b. Význam kontroly tejto amplifikačnej slučky je
ilustrovaný na príkladoch pacientov s geneticky determinovanými
defektmi faktorov H alebo I. Títo pacienti majú nedostatok C3 a
trpia zvýšenou náchylnosťou na určité spektrum infekcií.
Stabilizácia C konvertázy povrchom
aktivátora (protektora) (obrázok 7)
Ak sa naviaže vhodný aktivátor alternatívnej dráhy, C3b bude viazať
faktor B, ktorý je enzymaticky štiepený faktorom D a vytvára sa C3
konvertáza (C3bBb). Avšak, C3b je odolný voči degradácii faktorom I
a C3 konvertáza nie je rýchlo degradovaná, pretože je stabilizovaná
povrchom aktivátora. Komplex je ďalej stabilizovaný properdínom
viazaným na C3bBb. Aktivátory alternatívnej dráhy sú zložky
nachádzajúce sa na povrchu patogénov a zahŕňajú: lipopolysacharidy
gramnegatívnych baktérií a bunkových stien niektorých baktérií a
kvasiniek. Ak sa C3b naviaže na povrch aktivátora, vytvorená C3
konvertáza bude stabilná a bude pokračovať v tvorbe ďalších C3a a
C3b štiepením C3.
Tvorba C5 konvertázy (Obrázok
10)
Niektoré C3b vytvorené stabilizovanou C3 konvertázou na povrchu
aktivátora sa spájajú s komplexom C3bBb za vzniku komplexu C3bBbC3b.
Toto je C5 konvertáza alternatívnej cesty. Vytvorením C5 konvertázy
sa končí časť alternatívnej cesty. Alternatívna cesta môže byť
aktivovaná mnohými gramnegatívnymi (najmä Neisseria meningitidis a
Neisseria gonorrhoea), niektorými grampozitívnymi baktériami a
určitými vírusmi a parazitmi. Vedie k lýze týchto mikroorganizmov.
Alternatívna cesta aktivácie komplementu poskytuje ďalší prostriedok
ochrany proti určitým patogénom ešte pred navodením špecifickej
protilátkovej odpovede. Nedostatok C3 má za následok zvýšenú
náchylnosť na infekcie týmito mikroorganizmami. Alternatívnou cestou
je primitívnejšia cesta a z nej sa pravdepodobne vyvinula klasická a
lektínová cesta.
|
| |
|
| |
Alternatívna cesta predstavuje nástrok nešpecifickej imunity
proti infekcii bez účasti protilátok, a preto poskytuje prvú líniu obrany
proti množstvu infekčných vyvolávateľov.
Mnohé gramnegatívne a niektoré grampozitívne baktérie,
určité vírusy, parazity, heterológne červené krvinky, agregované
imunoglobulíny (najmä IgA) a niektoré ďalšie proteíny (napr. proteázy,
produkty koagulácie) môžu aktivovať alternatívnu cestu. Jeden proteín,
faktor jedu kobry, bol študovaný podrobne pre svoju schopnosť aktivovať túto
cestu.
|
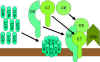 Obrázok 9 Lytická cesta
Obrázok 9 Lytická cesta |
Membránová útočná (lytická) cesta
(obrázok 9)
C5 konvertáza z klasickej (C4b2a3b), lektínovej (C4b2a3b) alebo
alternatívnej cesty (C3bBb3b) štiepi zložku C5 na fragmenty C5a a C5b. C5a
zostáva v kvapalnej fáze a C5b sa rýchlo spája so zložkami C6 a C7, následne
sa včlení do membrány. Potom sa viaže zložka C8, po nej nasleduje niekoľko
molekúl C9. Vytvárajú sa póry v membráne, kadiaľ dochádza k úniku bunkových
zložiek a k lýze. Lýza je enzymatický proces; predpokladá sa, že je
spôsobená fyzickým poškodením membrány. Komplex pozostávajúci z C5bC6C7C8C9
sa označuje ako membránový útočný komplex (MAC).
C5a fragment vytvorený v lytickej dráhe má niekoľko významných
biologických aktivít. Je to najsilnejší anafylatoxín. Okrem toho pôsobí ako
chemotaktický faktor pre neutrofily a stimuluje ich respiračné vzplanutie a
stimuluje produkciu zápalových cytokínov v makrofágoch. Jeho aktivity sú
kontrolované inaktiváciou karboxypeptidázou B (C3-INA).
Časť vytvoreného komplexu C5b67 sa môže oddeliť od membrány a vstúpiť do
kvapalnej fázy. Ak k tomu dôjde, potom sa môže viazať na iné blízke bunky a
viesť k ich lýze. Poškodeniu okolitých buniek bráni proteín S (vitronektín).
Proteín S sa viaže na rozpustný C5b67 a zabraňuje jeho väzbe na iné bunky.
|
 Obrázok
10 Regulácia C1rs (C4 convertáza) prostredníctvom C1-INH Obrázok
10 Regulácia C1rs (C4 convertáza) prostredníctvom C1-INH |
BIOLOGICKY AKTÍVNE PRODUKTY AKTIVÁCIE
KOMPLEMENTU Aktivácia komplementu vedie k
tvorbe niekoľkých biologicky aktívnych molekúl, ktoré prispievajú k rezistencii,
anafylaxii a zápalu.
Tvorba kinínov
Fragment C2b vytvorený počas klasickej cesty aktivácie komplementu je
prokinín, ktorý sa stáva biologicky aktívnym po enzymatickej alterácii
plazmínom. Nadmernej produkcii C2b bráni obmedzenie aktivácie zložky C2
prostredníctvom C1 inhibítora (C1-INH), známy je tiež pod názvom serpín,
ktorý vytlačí C1rs z komplexu C1qrs (obrázok 10). Geneticky podmienený
nedostatok C1-INH vedie k nadmernej produkcii C2b a je príčinou
angioneurotického edému. Tento stav sa môže liečiť Danazolom, ktorý
podporuje produkciu C1-INH alebo kyselinou ε-aminokapronovou, ktorá znižuje
aktivitu plazmínu.
|
|
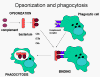 Obrázok 11
Obrázok 11
Komplementové proteíny sa viažu na povrch mikroorganizmov a podporujú
fagocytózu prostredníctvom komplementových receptorov
 Obrázok 12
Obrázok 12
Biologické efekty C5a
|
Anafylatoxíny
C4a, C3a a C5a sú všetky anafylatoxíny, ktoré spôsobujú degranuláciu
bazofilov / mastocytov a kontrakciu hladkého svalstva. Nežiaduce účinky
týchto peptidov sú kontrolované karboxypeptidázou B (C3a-INA).
Chemotaktické faktory
C5a a MAC (C5b67) pôsobia chemotakticky. C5a tiež účinne aktivuje neutrofily,
bazofily a makrofágy a vyvoláva tvorbu adhéznych molekúl na endotelových
bunkách ciev (obrázok 12).
Opsoníny
C3b a C4b na povrchu mikroorganizmov sa viažu na komplementový receptor
(CR1) na fagocytoch a podporujú fagocytózu (obrázok 11).
Ostatné biologicky
aktívne produkty aktivácie komplementu
Štiepne (degradačné) produkty C3 (iC3b, C3d a C3e) sa viažu na rôzne bunky s
odlišnými receptormi a modulujú ich funkcie.
Stručne povedané, komplementový systém sa zúčastňuje aj na
nešpecifickej aj na špecifickej rezistencii a vytvára množstvo produktov
biologického a patofyziologického významu (tabuľka 4).
Existujú známe geneticky determinované deficity jednotlivých
zložiek komplementu, ale deficit C3 zložky je najzávažnejší až fatálny. Deficity
komplementu sa vyskytujú aj pri imunokomplexových ochoreniach (napr. SLE) a
akútnych aj chronických bakteriálnych, vírusových a parazitárnych infekciách.
|
|
|
|
|
|
|
|
|
Tabuľka 4
Funkcia produktov aktivácie komplementu a ich kontrolné faktory |
| Fragment |
Funkcia |
Účinok |
Kontrolné faktory |
| C2a |
Prokinín, akumulácia tekutín |
Edém |
C1-INH |
| C3a |
Degranulácia bazofilov a
mastocytov, zvýšená vaskulárna permeabilita, kontrakcie hladkého
svalstva |
Anafylaxia |
C3a-INA |
| C3b |
Opsonín, aktivácia fagocytov |
Fagocytóza |
Factory H a I |
| C4a |
Degranulácia
bazofilov a mastocytov, zvýšená vaskulárna permeabilita,
kontrakcie hladkého svalstva |
Anafylaxia (menej silná) |
C3a-INA |
| C4b |
Opsonín |
Fagocytóza |
C4-BP a Factory I |
| C5a |
Degranulácia bazofilov a
mastocytov, zvýšená vaskulárna permeabilita, kontrakcie hladkého
svalstva |
Anafylaxia (najsilnejšia) |
C3a-INA |
| Chemotaxia, stimulácia
respiračného vzplanutia, aktivácia fagocytov, stimulácia
zápalových cytokínov |
Zápal |
| C5bC6C7 |
Chemotaxia |
Zápal |
Proteín S (vitronektín) |
| Pripája sa k iným membránam |
Tkanivové poškodenie |
|
|
Naučili ste sa
Proteíny komplementového systému
Rozdiely a podobnosti medzi rôznymi cestami aktivácie
C3
Výzhnam rôznych dráh aktivácie v nešpecifickej a
špecifickej imunite
Úloha rôznych produktov aktivácie komplementu pri
amplifikácii nešpecifickej a špecifickej imunite a zápale
|
|
Tabuľka 5
Deficit komplementu a ochorenia |
| Cesta / Zložka |
Ochorenie |
Mechanizmus |
| Klasická cesta |
|
| C1INH |
Hereditárny angioedém |
Nadmerná produkcia C2b (prokinín) |
| C1, C2, C4 |
Predispozícia k SLE |
Opsonizácia imunitných
komplexov im pomáha udržiavať ich rozpustnosť, nedostatok vedie
k zvýšenej precipitácii v tkanivách a k zápalu |
| Lektínová cesta |
|
| MBL |
Náchylnosť na bakteriálne
infekcie u dojčiat alebo imunosupresívnych pacientov |
Neschopnosť iniciovať
lektínovú cestu |
| Alternatívna cesta |
|
| Factory B alebo D |
Náchylnosť na pyogénne (hnisavé)
bakteriálne infekcie |
Nedostatočná opsonizácia
baktérií |
| C3 |
Náchylnosť na bakteriálne
infekcie |
Nedostatočná opsonizácia a
neschopnosť využívať membránový útočný komplex |
| C5, C6, C7 C8, a C9 |
Náchylnosť na infekcie
gramnegatívnymi mikroorganizmami |
Neschopnosť napadnúť vonkajšiu
membránu gramnegatívnych baktérií |
| Properdín (X-viazané) |
Náchylnosť na meningokokovú
meningitídu |
Nedostatočná opsonizácia
baktérií |
| Factory H alebo I |
C3 deficit a náchylnosť na
bakteriálne infekcie |
Nekontrolovaná aktivácia C3
alternatívnou cestou vedie k spotrebovaniu a vyčerpaniu C3 |
|
|

 |
 Návrat do
sekcie Imunológia on-line v oblasti Mikrobiológie a Imunológie on-line Návrat do
sekcie Imunológia on-line v oblasti Mikrobiológie a Imunológie on-line
This page last changed on
Saturday, December 09, 2017
Page maintained by
Richard Hunt
|

 A. Tvorba C3 konvertázy pri klasickej ceste
A. Tvorba C3 konvertázy pri klasickej ceste B Tvorba C5 konvertázy pri klasickej ceste
B Tvorba C5 konvertázy pri klasickej ceste
 Obrázok 3 Lektínová cesta
Obrázok 3 Lektínová cesta
 Obrázok 5
Obrázok 5 Obrázok
10 Regulácia C1rs (C4 convertáza) prostredníctvom C1-INH
Obrázok
10 Regulácia C1rs (C4 convertáza) prostredníctvom C1-INH






