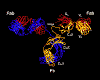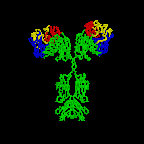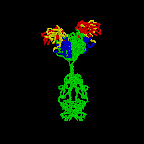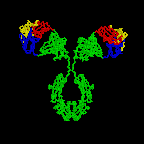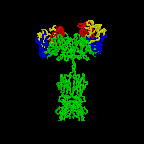|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGY |
IMMUNOLOGY |
MYCOLOGY |
PARASITOLOGY |
VIROLOGY |
|
VIDEO LECTURE
|
IMMUNOLOGIE – CHAPITRE
QUATRE
IMMUNOGLOBULINES - STRUCTURE ET FONCTION
Gene Mayer,
Ph.D.
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Denis
Hudrisier, Ph.D.
Centre national de la recherche scientifique (CNRS) · Institute of
Pharmacology and Structural Biology
Université de Toulouse
|
|

 |
|
EM PORTUGUES -
PORTUGUESE |
|
EN ANGLAIS - ENGLISH |
|
SHQIP - ALBANIAN |
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
LECTURES
Male et al. Immunology
7ème édition Chapitre 3
Murray, et al. Medical Microbiology
5ème edition, pp 110-113
OBJECTIFS DU COURS
Discuter les propriétés générales de toutes les immunoglobulines
Décrire la structure des immunoglobulines
Relier la structure des immunoglobulines à leur fonction
Définir les régions hypervariables et les régions assurant l’ossature
des immunoglobulines
Définir les classes et sous-classes, types et sous-types des
immunoglobulines
Décrire les structures et les fonctions des différentes classes
d’immunoglobulines
 Figure 1
Séparation éléctrophorétique des protéines du serum
Figure 1
Séparation éléctrophorétique des protéines du serum |
I. DEFINITION
Immunoglobuline (Ig)
Les immunoglobulines sont des glycoprotéines qui sont produites par les
plasmocytes en réponse à un immunogène et qui fonctionnent comme des
anticorps. Les immunoglobulines tirent leur nom de la découverte
qu’elles migrent avec les protéines globulaires lorsqu’un sérum immun (contenant
des anticorps) est placé dans un champ électrique (Figure 1).
II. FONCTIONS GENERALES DES
IMMUNOGLOBULINES
A. Liaison à l’antigène
Les immunoglobulines se lient de façon spécifique à un ou plusieurs
antigènes apparentés. Chaque immunoglobuline se lie en fait à un
déterminant antigénique spécifique. La liaison à l’antigène est la
première fonction des anticorps qui, en tant que telle, peut assurer une
protection de l’hôte. La valence de l’anticorps fait référence au nombre
de déterminants antigéniques que chaque molécule individuelle
d’anticorps peut lier. La valence de tous les anticorps est d’au moins
deux et peut être supérieure dans certains cas.
B. Fonctions effectrices
Souvent, la liaison de l’anticorps à l’antigène ne conduit à aucun effet
biologique direct. Les effets biologiques importants des anticorps sont
plutôt la conséquence de fonctions effectrices secondaires. Les
immunoglobulines possèdent des fonctions effectrices variées. En général,
pour qu’une fonction effectrice soit mise en œuvre, il faut que
l’anticorps se lie à l’antigène. Les immunoglobulines ne présentent pas
toutes l’ensemble des fonctions effectrices.
Les fonctions effectrices incluent:
1. Fixation du complément. Cela conduit à la lyse
des cellules et au relâchement de molécules biologiquement actives (voir
chapitre deux).
2. Liaison à des types cellulaires variés. Les
phagocytes, les lymphocytes, les plaquettes, les mastocytes, les
basophiles possèdent des récepteurs pour les immunoglobulines. Cette
liaison peut conduire les cellules à s’activer et à mettre en œuvre
des fonctions effectrices. Certaines immunoglobulines peuvent aussi
se lier à des récepteurs sur les trophoblastes du placenta, ce qui
conduit à leur passage au travers de la barrière placentaire. En
conséquence, les anticorps maternel transférés assurent l’immunité
du fœtus et du nouveau-né.
|
|
MOTS-CLES
Immunoglobuline
Valence
Chaîne lourde
Chaîne légère
Région variable
Région constante
Région charnière
Domaine
Région hypervariable
Région « Framework » (ossature)
Groupes & sous-groupes
Fab & Fc, F(ab')2
Type & sous-type
Classe & sous-classe
Opsonine
Chaîne J
Pièce sécrétoire
 Figure
2A Structure de base des immunoglobulines
Figure
2A Structure de base des immunoglobulines
 Figure 2B
Figure 2B
Cliquer sur l’image à gauche pour une démonstration animée de la
structure des anticorps
Requiert le Plug-In Chime. Obtenez Chime
here.
Developed by
Eric Martz.
Development supported by the Divisio.
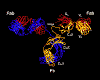 Figure 2C Représentation en ruban de la première structure intacte
d’anticorps jamais cristallisée (IgG2A).
Harris, L. J., Larson, S. B., Hasel, K. W., Day, J., Greenwood, A.,
McPherson, A. Nature 1992, 360, 369-372. © 2000
Antibody
Resource Page
Figure 2C Représentation en ruban de la première structure intacte
d’anticorps jamais cristallisée (IgG2A).
Harris, L. J., Larson, S. B., Hasel, K. W., Day, J., Greenwood, A.,
McPherson, A. Nature 1992, 360, 369-372. © 2000
Antibody
Resource Page
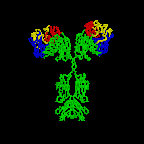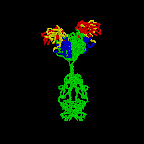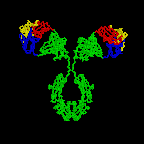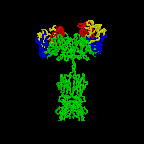 Figure 2D
Figure 2D
L’anticorps en rotation
Jose
Saldanha, Humanization by Design © 2000,
Antibody
Resource Page |
III. STRUCTURE DE BASE
DES IMMUNOGLOBULINES
La structure de base des immunoglobulines est illustrée dans
la Figure 2. Bien que différentes immunoglobulines puissent présenter des
variations structurales, elles sont toutes construites sur la même unité de
base.
A. Chaînes lourdes et légères
Toutes les immunoglobulines ont une unité de base formée d’une structure
comprenant quatre chaînes. Elles sont ainsi composées de deux chaînes
légères (L) identiques (23kD) et de deux chaînes lourdes (H) identiques
(50-70kD).
B. Ponts disulfures
1. Ponts disulfures inter-chaînes. Les chaînes
lourdes et légères, d’une part, et les deux chaînes lourdes, d’autre
part, sont maintenues ensemble par des ponts-disulfures inter-chaînes
ainsi que des liaisons non-covalentes. Le nombre de ponts disulfures
inter-chaînes varie en fonction des molécules d’immunoglobulines.
2. Ponts disulfures intra-chaînes. On trouve
également des ponts disulfures intra-chaîne au sein de chaque chaîne
polypeptidique.
C. Régions Variables (V) et Constantes (C)
Lorsque l’on compare les séquences en acides aminés de nombreuses
chaînes légères et chaînes lourdes différentes, il apparaît qu’à la fois
les chaînes lourdes et les chaînes légères peuvent être divisées en deux
régions basées sur la variabilité des séquences. Ce sont:
1. Pour la chaîne légère : les régions VL (110
acides aminés) et CL (110 acides aminés)
2. Pour la chaîne lourde : les régions VH (110
acides aminés) et CH (330-440 acides aminés)
D. Région charnière
C’est la région au niveau de laquelle les bras de la structure
d’anticorps sont en forme de Y. Cette région est appelée « charnière »
car c’est à ce niveau que la molécule présente un certain degré de
flexibilité.
E. Domaines
Les images de la structure tridimensionnelle de la molécule
d’immunoglobuline montrent que la structure est plus complexe que comme
représenté dans la figure 2A. En effet, elle est plutôt structurée en
régions globulaires, chacune d’entre elles contenant un pont disulfure
intra-chaîne (figure 2B-D). Ces régions sont appelées domaines.
1. Domaines de la chaîne légère : VL et CL
2. Domaines de la chaîne lourde VH, CH1 à CH3 (eventuellement
CH4)
F. Oligosaccharides
Des motifs oligosaccharidiques sont attachés au domaine CH2 de la
plupart des immunoglobulines. Dans certains cas, ces oligosaccharides
peuvent aussi être attachés sur d’autres parties de la molécule.
IV. STRUCTURE DE LA REGION VARIABLE
A. Région hypervariable (HVR) ou complementarity
determining regions (CDR)
La comparaison des séquences en acides aminés de régions variables de
nombreuses immunoglobulines montre que l’essentiel de la diversité
réside dans trois zones hypervariables (ou complementarity determining
region, c’est à dire des régions déterminant la complémentarité, sous
entendu avec l’antigène) comme illustré dans la Figure 3. Des anticorps
de spécificité antigénique différente (c’est à dire des sites de liaison
différents à l’antigène) auront des régions hypervariables différentes
alors que des anticorps de spécificité rigoureusement équivalente auront
des régions hypervariables identiques (les CDR forment en fait le site
de liaison de l’anticorps à l’antigène). Les régions hypervariables sont
trouvées à la fois sur les chaînes légères et les chaînes lourdes.
B. Régions assurant l’ossature (Framework)
Les régions placées entre les régions hypervariables au sein des
domaines variables assurent d’ossature (ou le squelette) (ou « framework
», figure 3) de l’immunoglobuline. En se basant sur les similarités et
les différences entre les régions« Framework » des domaines variables
des chaînes lourdes et légères, il est possible de définir des groupes
et des sous-groupes de chaînes lourdes et légères. Ce sont les produits
de gènes codant pour différentes régions variables.
|
 Figure 3 Structure de la région assurant l’ossature du domaine variable
Figure 3 Structure de la région assurant l’ossature du domaine variable

Cliquer sur l’image à gauche pour voir une structure moléculaire en
rotation d’un fragment Fab lié à un peptide de l’hémagglutinine du virus
de la grippe.
Requiert le Plug-In Chime. Obtenez Chime
here)
 Cliquer sur l’image à gauche pour voir les détails de l’interaction d’un
anticorps monoclonal de souris avec de lysozyme de blanc d’œuf de
poule .
Requiert le Plug-In Chime. Obtenez Chime
here)
Cliquer sur l’image à gauche pour voir les détails de l’interaction d’un
anticorps monoclonal de souris avec de lysozyme de blanc d’œuf de
poule .
Requiert le Plug-In Chime. Obtenez Chime
here) |
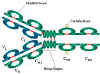
V. FRAGMENTS D’IMMUNOGLOBULINES:
RELATIONS STRUCTURE/FONCTION
Les fragments d’immunoglobulines générés par protéolyse se sont
révélés très utiles pour comprendre les relations structure/fonction des
immunoglobulines.
A. Fragment Fab
La digestion par la papaïne casse la molécule d’immunoglobuline au
niveau de la région charnière avant le pont disulfure inter-chaîne
(Figure 4). Cela conduit à la formation de deux fragments identiques
qui contiennent une chaîne légère et les domaines VH et CH1 d’une
chaîne lourde.
Liaison à l’antigène. Ces fragments ont été appelés Fab car
ils contiennent les sites de liaison à l’antigène de l’anticorps.
Chaque fragment Fab est monovalent alors que la molécule
d’origine est divalente. Le site de liaison de l’anticorps est
créé par la mise en commun des domaines VH et VL. Des
combinaisons de différents domaines VH et VL conduit à des
anticorps qui peuvent se lier à des déterminants antigéniques
différents.
B. Fragment Fc
La digestion par la papaïne génère aussi un fragment qui contient le
reste des deux chaînes lourdes contenant chacune les domaines CH2 et
CH3. Ce fragment a été appelé Fc car il cristallisait facilement.
|
 Figure 4 Fragments d’immunoglobulines: relations structure/fonction
Figure 4 Fragments d’immunoglobulines: relations structure/fonction |
Fonctions effectrices : les fonctions effectrices des
immunoglobulines sont essentiellement portées par cette partie de la
molécule. Des fonctions différentes sont portées par différents
domaines du fragment Fc (figure 5). Normalement, le fait qu’un
anticorps puisse exercer une fonction dépend de sa fixation
préalable à l’antigène ; il y a néanmoins des exceptions à cette
règle.
|
 Figure 5 Fragments d’immunoglobulines: relations structure/fonction
Figure 5 Fragments d’immunoglobulines: relations structure/fonction |
C. Fragment F(ab')2
Le traitement des immunoglobulines à la pepsine conduit à un clivage
de la chaîne lourde après le pont disulfure localisé entre les deux
chaînes lourdes, ce qui conduit à la formation d’un fragment
contenant les deux sites de liaison à l’antigène (figure 6). Ce
fragment a été appelé F(ab')2 car il est divalent. La région Fc de
la molécule est digérée en courts peptides suite au traitement à la
pepsine. Le fragment F(ab')2 se lie à l’antigène mais ne porte pas
les fonctions de l’anticorps.
|
 Figure 6 Fragments d’immunoglobulines: relations structure/fonction
Figure 6 Fragments d’immunoglobulines: relations structure/fonction |
VI. CLASSE, SOUS-CLASSES,
TYPES ET SOUS-TYPES DES IMMUNOGLOBULINES HUMAINES
A. Classes d’immunoglobulines
Les immunoglobulines peuvent être divisées en cinq classes différentes
selon les séquences en acides aminés des régions constantes des chaînes
lourdes. Toutes les immunoglobulines, au sein d’une classe donnée,
auront des régions constantes de chaînes lourdes très similaires. Ces
classes différentes peuvent être détectées par des études de séquençage
ou, plus communément, par des tests sérologiques (c’est à dire utilisant
des anticorps dirigés contre ces différences).
1. IgG : chaîne lourde « Gamma »
2. IgM : chaîne lourde « Mu »
3. IgA : chaîne lourde « Alpha »
4. IgD : chaîne lourde « Delta »
5. IgE : chaîne lourde « Epsilon »
B. Sous-classe d’immunoglobulines
Les classes d’immunoglobulines peuvent être subdivisées en sous-classe
en fonction de légères différences en acides aminés présentes dans la
région constante des chaînes lourdes. Toutes les immunoglobulines, au
sein d’une sous-classe donnée, auront des régions constantes de chaînes
lourdes très similaires. De nouveau, ces différences peuvent être mises
en évidence par des moyens sérologiques.
1. Sous-classes d’IgG
a) IgG1 : chaîne lourde Gamma 1
b) IgG2 : chaîne lourde Gamma 2
c) IgG3 : chaîne lourde Gamma 3
d) IgG4 : chaîne lourde Gamma 4
2. Sous-classes d’IgA
a) IgA1 : chaîne lourde Alpha 1
b) IgA2 : chaîne lourde Alpha 2
|
| |
C. Types
d’immunoglobulines
Les immunoglobulines peuvent aussi être classées en types en fonction de la
chaîne légère dont elles disposent. Les types de chaînes légères sont basés
sur des différences dans la séquence des acides aminés de la région
constante. Là encore, ces différences peuvent être mises en évidence par des
moyens sérologiques. On distingue :
1. Chaînes légères de
type Kappa
2. Chaînes légères de
type Lambda
D. Sous-types
d’immunoglobulines
Les chaînes
légères peuvent également être subdivisées en sous-types en fonction de
différences légères dans la séquence en acides aminés des régions constantes
de la chaîne légère au sein d’un type donné.
1. Sous-types Lambda
a) Lambda 1
b) Lambda 2
c) Lambda 3
d) Lambda 4
E. Nomenclature
Les
immunoglobulines sont dénommées sur la base de leur classe, ou de leur
sous-classe de chaîne lourde et sur leur type, ou sous-type de chaîne
légère. En absence de précision, il faut admettre que toutes les classes,
sous-classe, types ou sous-types sont présents dans un échantillon
biologique. IgG signifie que toutes les sous-classes d’IgG et tous les types
sont présents dans une échantillon biologique.
F. Hétérogénéité
Les
immunoglobulines, prises en tant que population de molécules, sont
normalement très hétérogènes car elles sont composées non seulement de
différentes classes et sous-classes de molécules chacune composée de types
et de sous-types de chaînes légères différentes mai aussi car elles peuvent
avoir des propriétés de liaison à des antigènes différents du fait de la
diversité des régions VH et VL.
|
 Figure
7 Structure d’une IgG Figure
7 Structure d’une IgG |
VII. STRUCTURE ET PROPRIETES DE
CLASSES ET SOUS-CLASSE D’IMMUNOGLOBULINESIG CLASSES
A. IgG
1. Structure
Les structures des sous-classes d’IgG sont présentées dans la
Figure 7. Toutes les IgG sont des monomères (immunoglobulines
7S). Les sous-classes diffèrent par le nombre de ponts
disulfures et la longueur de la région charnière.
2. Propriétés
La classe d’anticorps IgG présente l’ensemble des fonctions qui
peuvent être réalisées par des molécules d’immunoglobulines.
a) Les IgG sont les immunoglobulines majoritaires dans le
sérum : 75% des immunoglobulines sériques sont des IgG
b) Les IgG sont les immunoglobulines majoritaires dans
l’espace extravasculaire
c) Transfert placentaire : l’IgG est la seule classe
d’immunoglobulines pouvant traverser la barrière placentaire.
Le transfert est possible grâce à un récepteur pour la
région Fc des IgG exprimé par les cellules placentaires.
Toutes les sous-classes ne sont pas transférées de façon
équivalent : les IgG2 ne sont pas bien transportées.
d) Fixation du complément : toutes les sous-classes d’IgG
ne fixent pas le complément : c’est le cas de l’IgG4
e) Liaison aux cellules : les macrophages, monocytes,
neutrophiles et certains lymphocytes possèdent des
récepteurs pour la partie Fc des IgG. Toutes les sous-classes
ne se fixent pas bien; les IgG2 et IgG4 ne se lient pas bien
aux récepteurs Fc. Une des conséquences de la liaison des
immunoglobulines aux récepteurs Fc présents sur les
neutrophiles, monocytes et macrophages est que ces cellules
peuvent internaliser l’antigène plus efficacement :
l’anticorps a sensibilisé l’antigène à l’internalisation par
les phagocytes. Le terme opsonine est utilisé pour décrire
des substances qui augmentent la phagocytose. Les IgG sont
donc de bonnes opsonines. La liaison des IgG sur les
récepteurs Fc présents sur d’autres types cellulaires
conduit à l’activation d’autres fonctions que la phagocytose
sur ces cellules.
|
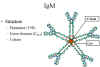 Figure 8 Structure pentamérique d’une IgM sérique
Figure 8 Structure pentamérique d’une IgM sérique
 Figure 9 Structure d’une IgM de surface
Figure 9 Structure d’une IgM de surface
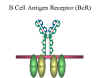 Figure 10 Le récepteur à l’antigène des cellules B (B cell antigen
receptor ; BcR)
Figure 10 Le récepteur à l’antigène des cellules B (B cell antigen
receptor ; BcR) |
B. IgM
1. Structure
La structure des IgM est présentée figure 8. Les IgM existent
normalement sous la forme de pentamères (immunoglobulines 19S) mais
peuvent aussi exister sous la forme de monomères. Dans leur forme
pentamérique, toutes les chaînes lourdes et toutes les chaînes
légères sont identiques. La valence des IgM pentamériques est donc
théoriquement de 10. Les IgM ont un domaine surnuméraire sur la
chaîne mu (nommé CH4) et sont associées de façon covalente, par un
pont disulfure, à une autre protéine appelée chaîne J.
2. Propriétés
a) L’IgM est la troisième immunoglobuline en
termes d’abondance dans le sérum.
b) L’IgM est la première immunoglobuline à être
produite par le fœtus ainsi que la première immunoglobuline
produite par les lymphocytes B « naïfs » après qu’ils aient été
stimulés par l’antigène.
c) Grâce à sa structure pentamérique, l’IgM fixe
bien le complément. Les IgM sont des anticorps très efficaces
pour lyser les micro-organismes.
d) Toujours grâce à sa structure pentamérique,
l’IgM est aussi un bon anticorps agglutinant. Ainsi les IgM sont
de bons anticorps pour agglutiner les micro-organismes ce qui
conduit à leur élimination par le corps.
e) Les IgM se fixent à certaines cellules par le
biais de récepteurs Fc.
f) Immunoglobuline de surface des cellules B
L’IgM de surface se présente sous la forme d’un monomère, sans
chaîne J mais possède une extension de 20 acides aminés
supplémentaires à son extrémité C-terminale permettant l’ancrage
à la membrane (Figure 9). L’IgM de surface est le récepteur à
l’antigène des lymphocytes B. L’IgM de surface est associée à
deux protéines de la membrane des cellules B appelées Ig-alpha
et Ig-beta comme indiqué dans la Figure 10. Ces protéines
assurent la transduction du signal car la queue cytoplasmique de
l’IgM de surface est trop courte pour transduire les signaux. La
liaison de l’antigène à l’immunoglobuline de surface est requise
pour que la transduction du signal par les chaînes Ig-alpha et
Ig-beta ait lieu. Dans le cas des antigènes T-indépendants, la
liaison de l’antigène à l’immunoglobuline de surface est
suffisante pour permettre l’activation de la cellule B et sa
différenciation en plasmocyte sécréteur d’anticorps. Par contre,
dans le cas des antigènes T-dépendants, un second signal apporté
par les lymphocytes T auxiliaires est nécessaire pour que les
cellules B soient activées.
|

Figure 11 Structure d’une IgA
 Figure
12 Origine des IgA solubles Figure
12 Origine des IgA solubles |
C. IgA
1. Structure
Les IgA trouvées dans le sérum sont monomériques mais celles
présentes dans les sécrétions sont sous la forme de dimères comme
présenté dans la Figure 11. Sous la forme dimérique, l’IgA est
associée à une chaîne J.
L’IgA trouvée dans les sécrétions est également associée à une
autre molécule : la pièce sécrétoire ou chaîne T ; l’IgA présente
dans les sécrétion (ou sIgA) est parfois appelée immunoglobuline
11S. Contrairement au reste des IgA qui sont produites dans les
plasmocytes, la pièce sécrétoire est produite dans les cellules
épithéliales et est ajoutée à l’IgA lorsque celle-ci passe dans les
sécrétions. (Figure 12). La pièce sécrétoire facilite le transport
de l’IgA au travers de la muqueuse et protège également l’IgA de la
dégradation dans les sécrétions.
2. Propriétés
a) L’IgA est la seconde immunoglobuline en abondance dans le
sérum.
b) L’IgA est la principale immunoglobuline retrouvée dans les
sécrétions, larmes, salive, colostrum, mucus. De par sa présence
dans les sécrétions, l’IgA sécrétée est important dans
l’immunité locale (mucosale).
c) Normalement les IgA ne fixent pas le complément sauf si
elles sont sous forme agrégée.
d) L’IgA peut se lier à certaines cellules comme les
neutrophiles et certains lymphocytes.
|
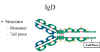 Figure 13 Structure
d’une IgD
Figure 13 Structure
d’une IgD |
D. IgD
1. Structure
La structure de l’IgD est présentée dans la Figure 13. L’IgD
n’existe que sous la forme de monomère.
2. Propriétés
a) L’IgD est retrouvée à de bas niveau dans le
sérum; son rôle dans le sérum n’est pas clair.
b) L’IgD est principalement retrouvée à la
surface des cellules B où elle agit comme récepteur pour
l’antigène. L’IgD de surface possède des acides aminés
supplémentaires à son extrémité C-terminale permettant un
ancrage à la membrane. Elle est associée aux chaînes Ig-alpha et
Ig-beta chains.
c) L’IgD de se fixe pas au complément.
|
 Figure 14 Structure d’une IgE
Figure 14 Structure d’une IgE |
E. IgE
1. Structure
La structure des IgE est présentée dans la Figure
14. L’IgE existe sous la forme de monomère et possède un domaine
supplémentaire dans la région constante..
2. Propriétés
a) L’IgE est l’immunoglobuline la moins
abondante dans le sérum car elle se lie fortement à des
récepteurs Fc présents sur les basophiles et les mastocytes
avant même d’interagir avec l’antigène.
b) Les IgE sont impliquées dans les réactions
allergiques. L’implication des IgE dans les réponses allergiques
résulte de leur liaison aux mastocytes et aux basophiles. La
liaison des allergènes aux IgE présents sur ces cellules conduit
au relâchement de divers médiateurs pharmacologiques qui sont
responsables des symptômes allergiques.
c) Les IgE jouent aussi un rôle dans les
maladies parasitaires dues à des helminthes. Dans la mesure où
les niveaux d’IgE augmentent au cours des maladies parasitaires,
ce dosage est utile pour diagnostiquer ce type d’infections. Les
éosinophiles possèdent des récepteurs Fc pour les IgE et la
liaison des éosinophiles aux helminthes recouverts d’IgE conduit
à l’élimination du parasite.
d) Les IgE ne fixent pas le complément.
|
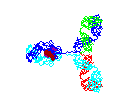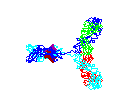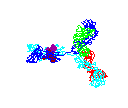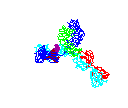 Figure 15
Anticorps en rotation
© 2000
Antibody Resource Page Antibody
Concepts
Figure 15
Anticorps en rotation
© 2000
Antibody Resource Page Antibody
Concepts |
Implication DES CLASSES D’Immunoglobulines HUMAINES EN CLINIQUE
Adapté de:F.T. Fischbach in
"A Manual of Laboratory Diagnostic Tests," 2nd Ed., J.B. Lippincott Co.,
Philadelphia, PA, 1984.
IgG
1. Les IgG sont augmentées
dans les situations suivantes:
a) Infections
granulomateuses chroniques
b) Infections de tout types
c) Hyper-immunisation
d) Maladies du foie
e) Malnutrition (sévère)
f) Dysprotéinémie
g) Pathologies associées aux granulomes liés aux réactions
d’hypersensibilité, maladies dermatologiques, myélomes à IgG.
h) Polyarthrite rhumatoïde
2. Les IgG sont diminuées
dans les situations suivantes:
a) Agammaglobulinémie
b) Aplasie lymphoïde
c) Déficit en IgG, déficience en IgA
d) Myélomes à IgA
e) Protéinémie de Bence Jones
f) Leucémie lymphoblastoïde chronique.
IgM
1. Les IgM sont augmentées
dans les situations suivantes (chez l’adulte):
a) Macoglobulinémie de
Waldenström's
b) Trypanosomiasie
c) Actinomycoses
d) Maladie de Carrión (bartonelloses)
e) Malaria
f) Mononucléose infectieuse
g) Lupus érythémateux disséminé
h) Polyarthrite
rhumatoïde
I) Dysgammaglobulinémie (certain cas)
Note:
Chez le nouveau-né, un niveau d’IgM supérieur à 20 ng/dl est indicateur d’une
stimulation intra-utérine du système immunitaire par le virus de la rubéole, le
cytomégalovirus, la syphilis ou la toxoplasmose.
2. Les IgM sont diminuées
dans les situations suivantes:
a) Agammaglobulinémie
b) Maladies lymphoprolifératives (certain cas)
c) Aplasie lymphoïde
d) Myélomes à IgG et à IgA
e) Dysgammaglobulinémie
f) Leucémie lymphoblastique chronique
IgA
1. Les IgA sont augmentées
dans les situations suivantes:
a) Syndrome de Wiskott-Aldrich
b) Cirrhoses du foie (dans la plupart des cas)
c) Certain stades de pathologies auto-immunes comme la polyarthrite
rhumatoïde et le lupus érythémateux disséminé.
d) Infections chronique ne résultant pas de déficits immunologiques.
e) Myélomes à IgA
2. Les IgA sont diminuées
dans les situations suivantes:
a) Ataxia
telangiectasia héréditaire
b) Déficits immunologiques (par exemple : dysgammaglobulinémie,
agammaglobulinémies acquises et congénitales, hypo-gammaglobulinémies)
c) Syndrome de malabsorption
d) Aplasie lymphoïde
e) Myélome à IgG
f) Leucémie lymphoblastique aigüe
g) Leucémie lymphoblastique chronique
IgD
1. Les IgD sont augmentées
dans les situations suivantes:
a) Infections
chroniques
b) Myélomes à IgD
IgE
1. Les IgE sont augmentées
dans les situations suivantes:
a) Maladies atopiques
de la peau et maladies de peau comme l’eczéma.
b) Hay
fever
c) Asthme
d) Choc anaphylactique
e) Myélome à IgE
2. Les IgE sont diminuées
dans les situations suivantes:
a) Agammaglobulinémie
congénitale
b) Hypogammaglobulinémie due à des défauts métaboliques ou de synthèse
des immunoglobulines.
|
|


|
 Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
This page last changed on
Thursday, October 25, 2012
Page maintained by
Richard Hunt
Please report any problems to
richard.hunt@uscmed.sc.edu
|

 Figure 3 Structure de la région assurant l’ossature du domaine variable
Figure 3 Structure de la région assurant l’ossature du domaine variable
 Figure 4 Fragments d’immunoglobulines: relations structure/fonction
Figure 4 Fragments d’immunoglobulines: relations structure/fonction Figure 5 Fragments d’immunoglobulines: relations structure/fonction
Figure 5 Fragments d’immunoglobulines: relations structure/fonction Figure 6 Fragments d’immunoglobulines: relations structure/fonction
Figure 6 Fragments d’immunoglobulines: relations structure/fonction Figure
7 Structure d’une IgG
Figure
7 Structure d’une IgG Figure 8 Structure pentamérique d’une IgM sérique
Figure 8 Structure pentamérique d’une IgM sérique

 Figure 13 Structure
d’une IgD
Figure 13 Structure
d’une IgD Figure 14 Structure d’une IgE
Figure 14 Structure d’une IgE Figure 15
Anticorps en rotation
© 2000
Antibody Resource Page Antibody
Concepts
Figure 15
Anticorps en rotation
© 2000
Antibody Resource Page Antibody
Concepts