|
x |
x |
|
 |
 |
|
INFEKČNÉ OCHORENIA
|
BACTERIOLÓGIA |
IMUNOLÓGIA |
MYKOLÓGIA |
PARAZITOLÓGIA |
VIROLÓGIA |
|
ENGLISH
|
 |
UNIVERZITA KOMENSKÉHO V
BRATISLAVE
JESSENIOVA LEKÁRSKA FAKULTA V MARTINE
Ústav mikrobiológie a imunológie
Sklabinská 26 , 036 01 Martin
|
 |
IMMUNOLÓGIA – KAPITOLA PRVÁ
VRODENÁ (NEŠPECIFICKÁ)
IMUNITA
Gene Mayer, Ph.D
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Překlad:
Elena
Novakova, MD, PhD
a
MUDr. Martina Neuschlová, PhD.
Institute of
Microbiology and Immunology
Jessenius Faculty of Medicine in Martin
Comenius University in Bratislava
|
|
VIETNAMESE |
|
FRENCH |
|
SPANISH |
|
PORTUGUESE |
|
ALBANIAN |
|
TURKISH |
|
Let us know what you think
SPÄTNÁ VÄZBA |
|
VYHĽADÁVANIE |
|
|
|
 |
|
Logo image
© Jeffrey Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
CIELE VÝUČBY
Rozpoznať význam imunitného systému v boji proti infekciám a
chorobám
Rozlíšiť medzi nešpecifickým (vrodeným) a špecifickým (získaným)
imunitným systémom
Objasniť mechanizmy bojújúce proti infekcii / chorobe (zabíjanie
patogénov)
Poznať humorálne a bunkové zložky nešpecifickej imunity
oznámiť sa s mechanizmom účinku humorálnych a bunkových zložiek
nešpecifickej imunity
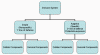 Obrázok 1
Obrázok 1
Prehľad imunitného systému
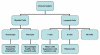 Obrázok 2
Obrázok 2
Bunky imunitného systému
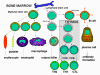 Obrázok 3
Obrázok 3
Vznik a vývoj buniek imunity
|
PREHĽAD IMUNITNÉHO SYSTÉMU
Počas života sme neustále vystavovaní pôsobeniu infekčných agensov a
napriek tomu sme vo väčšine prípadov schopní odolávať infekciám. Je to
náš imunitný systém, ktorý nám umožňuje odolávať infekciám. Imunitný
systém pozostáva z dvoch hlavných subdivízií: vrodeného (nešpecifického)
imunitného systému a získaného (špecifického) imunitného systému (obrázok
1). Vrodený imunitný systém je našou prvou líniou obrany proti
mikroorganizmom, ktoré nás napadli, zatiaľ čo získaný imunitný systém
pôsobí ako druhá obranná línia a zároveň chráni organizmus pri opätovnom
vystavení rovnakému patogénu. Každá z hlavných subdivízií imunitného
systému má aj bunkové (celulárne) aj protilátkové (humorálne) zložky,
ktorými vykonáva svoju funkciu (obrázok 1). Navyše, vrodený imuntný
systém má aj anatomické vlastnosti, ktoré fungujú ako bariéry proti
infekcii. Hoci tieto dve hlavné zložky imunitného systému majú odlišné
funkcie, existuje vzájomné prepojenie medzi týmito zložkam (tj.
komponenty vrodeného imunitného systému ovplyvňujú získaný imunitný
systém a platí to aj naopak).
Aj keď obidva, teda vrodený aj získaný imunitný systém
chránia organizmus pred napadnutím mikroorganizmom, líšia sa mnohými
spôsobmi, ako to vykonávajú. Získaný imunitný systém vyžaduje určitý čas
na reagovanie voči napádajúcemu mikroorganizmu. Vrodený imunitný systém
je z veľkej časti pripravený mobilizovať sa rýchlo po invázii
napádajúcim mikroorganizmom. Získaný imunitný systém však disponuje
imunologickou pamäťou. Pamätá si, ak sa už stretol s určitým
mikroorganizmom v minulosti a reaguje rýchlejšie pri nasledujúcom
kontakte s tým istým mikroorganizmom. Naproti tomu vrodený imunitný
systém nevykazuje imunologickú pamäť.
Všetky bunky imunitného systému majú svoj pôvod v kostnej dreni a
zahŕňajú myeloidné (neutrofily, bazofily, eozinofily, makrofágy a
dendritové bunky) a lymfoidné (B-lymfocyty, T-lymfocyty a NK bunky)
bunky (obrázok 2), ktoré sa diferencujú odlišnými cestami (obrázok 3). Z
myeloidnej progenitorovej bunky v kostnej dreni vznikajú erytrocyty,
krvné doštičky, neutrofily, monocyty /makrofágy a dendritové bunky. Z
lymfoidných progenitorových buniek vznikajú NK bunky, T bunky a B bunky.
Pre vývoj T buniek musia prekurzorové T bunky cestovať do týmusu, kde sa
podrobia diferenciácii na odlišné typy T buniek, CD4+ T helper bunky (pomocné)
a CD8+ T pre-cytotoxické bunky. Tvoria sa dva typy pomocných Th buniek:
Th1 a Th2. Th1 pomáhajú CD8+ T pre-cytotoxickým bunkám diferencovať sa
na cytotoxické T bunky a Th2 pomáhajú B bunkám diferencovať sa na
plazmatické bunky, ktoré produkujú protilátky.
Hlavná funkcia imunitného systému je rozpoznávať čo je vlastné (self) a
čo je cudzie (non-self). Táto schopnosť rozlíšiť vlastného od cudzieho
je nevyhnutná pri ochrane organizmu pred napádajúcimi patogénmi a pri
odstraňovaní poškodených alebo inak zmenených buniek organizmu (napr.
malígnych buniek). Keďže niektoré patogény sa môžu replikovať
intracelulárne (vírusy, niektoré baktérie a parazity) a iné zas
extracelulárne (väčšina baktérií, húb a parazitov), vyvinuli sa rôzne
zložky imunitného systémuna ochranu organizmu proti týmto rôznym typom
patogénov. Je dôležité uvedomiť si, že infekcia mikroorganizmom nemusí
vždy znamenať chorobu, pretože imunitný systém vo väčšine prípadov bude
schopný eliminovať infekciu ešte predtým, ako sa choroba vyvinie.
Choroba sa vyskytne vtedy, keď je infekčná dávka vysoká, keď je
virulencia mikroorganizmu veľká alebo imunita kompromitovaná. Hoci
imunitný systém má z väčšej časti pozitívny efekt, môže mať aj účinok
škodlivý. Počas zápalu, ktorý je odpoveďou na napadnutie mikroorganizmom,
môže dôjsť k lokálnemu diskomfortu a poškodeniu okolitého zdravého
tkaniva v dôsledku toxických látok vyprodukovaných imunitnou odpoveďou.
V niektorých prípadoch môže byť imunitná odpoveď namierená voči vlastným
tkanivám, čo vedie k vzniku autoimunitného ochorenia.
|
Tabuľka 1 |
|
Nešpecifická imunita |
Špecifická imunita |
| Odpoveď je
antigén-nezávislá |
Odpoveď je
antigén-závislá |
|
Vzniká okamžitá maximálna odpoveď |
Vzniká oneskorenie medzi expozíciou antigénu a maximálnou odpoveďou |
| Nie je
antigén-špecifická |
Je
antigén-špecifická |
|
Nevzniká imunologická pamäť po expozícii antigénu |
Vzniká imunologická pamäť po expozícii antigénu |
|
| |
VRODENÁ (NEŠPECIFICKÁ)
IMUNITA
Prvky vrodeného (nešpecifického) imunitného systému (tabuľka 2)
zahŕňajú anatomické bariéry, sekrečné molekuly a bunkové zložky. Medzi
mechanické anatomické bariéry patria koža a vnútorné epitelové vrstvy, pohyb
čriev a bronchopulmonálnych cílií. S tým súvisia aj chemické a biologické
bariéry.
Anatomické bariéry
proti infekciám
Mechanické faktory
Epitely tvoria mechanickú bariéru, ktorá je pre väčšinu infekčných
vyvolávateľov málo priepustná. Koža teda pôsobí ako naša prvá obranná
línia proti útočiacim mikroorganizmom. Odlupovanie odumretých
zrohovatených buniek jej najvrchnejšej vrstvy tiež pomáha odstraňovať
baktérie a iné infekčné vyvolávatele prichytené na povrch týchto vrstiev.
Pohyb vykonávaný cíliami alebo peristaltikou pomáha udržiavať respiračný
trakt a gastrointestinálny trakt bez nebezpečných mikroorganizmov. Slzy
a sliny pomáhajú predchádzať infekciám očí a úst. Hlien, ktorý pokrýva
sliznice respiračného a gastrointestinálneho traktu pomáha chrániť pľúca
a zažívací trakt pred infekciami.
Chemické faktory
Mastné kyseliny v pote inhibujú rast baktérií. Lyzozým a fosfolipáza
nachádzajúce sa v slzách, slinách a nosovom sekréte môžu rozkladať
bunkovú stenu baktérií a narušovať membrány baktérií. Nízke pH potu a
žalúdočných sekrétov bráni rastu baktérií. Defenzíny (proteíny s nízkou
molekulovou hmotnosťou) nachádzajúce sa v pľúcach a gastrointestinálnom
trakte majú antimikrobiálnu aktivitu. Pot tiež obsahuje antimikrobiálne
peptidy s nízkou molekulovou hmotnosťou, ktoré pôsobia na bunkové
membrány baktérií (vrátane MRSA), v ktorých vytvárajú kanály umožňujúce
prechod vody a iónov, čo narušuje transmembránový potenciál, a to vedie
k smrti bunky. Surfaktant v pľúcach pôsobí ako opsonín (látka, ktora
podporuje fagocytózu častíc fagocytujúcimi bunkami).
Biologické faktory
Normálna flóra kože a gastrointestinálneho traktu môže zabrániť
kolonizácii patogénnymi baktériami konkurenciou s patogénnymi baktériami
o živiny, vylučovaním toxických látok, adherovaním na bunkové povrchy.
Humorálne bariéry
proti infekciám
Anatomické bariéry sú veľmi účinné pri prevencii kolonizácie tkanív
mikroorganizmami. Avšak, ak dôjde k poškodeniu tkanív, narušia sa anatomické
bariéry a infekcia sa môže vzniknúť. Akonáhle infekční vyvolávatelia
preniknú do tkanív, vstupuje do hry ďalší vrodený imunitný mechanizmus, a to
akútny zápal. Humorálne faktory hrajú dôležitú úlohu v zápale, ktorý je
charakterizovaný edémom a priťahovaním fagocytujúcich buniek. Tieto
humorálne faktory sa nachádzajú v sére alebo sa tvoria v mieste infekcie.
Komplementový systém
Komplement je hlavný humorálny nešpecifický obranný mechanizmus (viď
kapitola komplement). Po aktivácii komplementu môže dôjsť k zvýšenej cievnej
permeabilite, pritiahnutiu fagocytov a k lýze a opsonizáci baktérií.
Koagulačný systém
V závislosti od závažnosti poškodenia tkaniva môže alebo nemusí byť
aktivovaný koagulačný systém. Niektoré produkty koagulačného systému
môžu prispievať k nešpecifickej obrane kvôli svojej schopnosti zvyšovať
cievnu permeabilitu a pôsobiť ako chemotaktické látky pre fagocyty.
Navyše niektoré produkty koagulačného systému sú priamo antimikrobiálne.
Napríklad betalyzín, proteín produkovaný krvnými doštičkami počas
koagulácie, môže lyzovať mnoho grampozitívnych baktérií pôsobením ako
katiónový detergent.
Laktoferín a transferín
Tieto proteíny obmedzujú rast baktérií tým, že viažu železo, čo je
základný nutričný faktor pre baktérie.
Interferóny
Interferóny sú proteíny, ktoré môžu obmedzovať replikáciu vírusov v
bunkách.
Lyzozým
Lyzozým štiepi bunkovú stenu baktérií.
Interleukín-1
Il-1 vyvoláva horúčku a produkciu proteínov akútnej fázy, z ktorých
niektoré pôsobia antimikrobiálne, pretože opsonizujú baktérie.
|
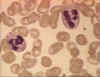 Obrázok 4A Dva neutrofily v krvnom nátere
Obrázok 4A Dva neutrofily v krvnom nátere
© Bristol Biomedical Image Archive (použité so súhlasom)
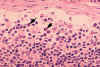 Obrázok 4B Histopatológia lymfadenopatie pri infekcii HIV-1. Subkapsulárny
sínus. Sínus obsahuje zvýšený počet neutrofilov.
Obrázok 4B Histopatológia lymfadenopatie pri infekcii HIV-1. Subkapsulárny
sínus. Sínus obsahuje zvýšený počet neutrofilov.
CDC/Dr. Edwin P. Ewing, Jr.
 Obrázok 4C
Obrázok 4C
Neutrofil – electrónová mikroskopia. Dva segmenty jadra a azurofilné
granuly
© Dr Louise Odor, University of South Carolina School of
Medicine
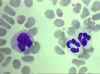 Obrázok 4D Krvný náter a monocyt (vľavo) a dva neutrofily
Obrázok 4D Krvný náter a monocyt (vľavo) a dva neutrofily
© Bristol Biomedical Image Archive (použité so súhlasom)
|
|
Tabuľka 2
Fyzikálno-chemické bariéry proti infekcii
|
|
Systém/Orgán |
Aktívna zložka |
Efektorový mechanizmus |
|
Koža |
Odlupujúce sa bunky; pot |
Odlupovanie; obmývanie, organické kyseliny |
|
GIT |
Bunky cylindrického epitelu |
Peristaltika, nízke pH, žlčová kyselina, obmývanie, tiokyanát |
|
Pľúca |
Tracheálny riasinkový epitel |
Mucociliárny transport, surfaktant |
|
Nazofarynx a oči |
Hlien, sliny, slzy |
Obmývanie, lyzozým |
|
Cirkulácia a lymfoidné orgány |
Fagocyty
NK
bunky a K-bunky
LAK
|
Fagocytóza a intracelulárne zabíjanie
Priama a protilátkami sprostredkovaná lýza buniek
Interleukínom IL-2 aktivovaná lýza buniek
|
|
Sérum |
Laktoferín a transferín |
Viazanie železa |
|
Interferóny |
Antivirusovo pôsobiaced proteíny |
| TNF-alfa |
Antivírusová aktivita, aktivácia fagocytov |
|
Lyzozým |
Hydrolýza peptidoglykánov |
|
Fibronektín |
Opsonizácia a fagocytóza |
|
Complement |
Opsonization, enhanced phagocytosis, inflammation |
|
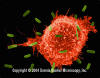 Obrázok 5
Obrázok 5
Makrofág útočiaci na E.coli (SEM x8,800)
© Dr Dennis Kunkel (použité so súhlasom)
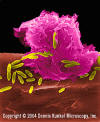 Obrázok 6
Obrázok 6
Alveolárny (pľúcny) makrofág útočiaci na E. coli (SEM x10,000)
© Dr Dennis Kunkel (použité so súhlasom)
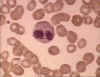 Obrázok 6A Eozinofil v krvnom nátere
Obrázok 6A Eozinofil v krvnom nátere
© Bristol Biomedical Image Archive (použité so súhlasom)
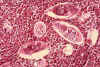 Obrázok 6B
Obrázok 6B
Histopatológia močového mechúra ukazuje vajíčka Schistosoma haematobium
obklopené infiltrátmi eozinofilov
CDC/Dr. Edwin P. Ewing, Jr.
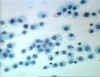 Obrázok 7
Obrázok 7
Histiocyty – dlho prežívajúce makrofágy nájdené v tkanivách.
© Bristol Biomedical Image Archive (použité so súhlasom)
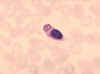 Obrázok 8 Monocyty s pohlteným parazitom malárie.
Obrázok 8 Monocyty s pohlteným parazitom malárie.
CDC/Dr. Melvin
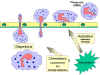 Obrázok
9 Chemotaktická odpoveď na zápalový podnet Obrázok
9 Chemotaktická odpoveď na zápalový podnet |
Bunkové bariéry proti infekciám
Časťou zápalovej odpovede je priťahovanie polymorfonukleárnych neutrofilov,
eozinofilov a makrofágov do miesta infekcie. Tieto bunky sú hlavnou líniou
obrany v nešpecifickej imunitnej odpovedi.
Neutrofily
Polymorfonukleárne bunky (PMNL, obrázok 4) sú priťahované do miesta
infekcie, kde fagocytujú mikróby a usmrcujú ich intracelulárne. Zároveň
však PMNL súčasne prispievajú k poškodeniu tkaniva počas prebiehajúceho
zápalu.
Makrofagy
Tkanivové makrofágy (obrázok 5, 6, 7) a ďalšie priťahované monocyty (obrázok
4 a 8), z ktorých sa diferencujú makrofágy, zohrávajú významnú úlohu vo
fagocytóze a intracelulárnom zabíjaní mikróbov. Makrofágy sú schopné aj
extracelulárneho zabíjania infikovaných alebo poškodených vlastných
cieľových buniek. Okrem toho, makrofágy prispievajú k reparačným
procesom v tkanivách a fungujú ako antigén prezentujúce bunky, ktoré sú
potrebné na vyvolanie špecifických imunitných odpovedí.
Prirodzené zabíjače (NK bunky) a lymfokínom
aktivované zabíjače (LAK bunky)
NK a LAK bunky môžu nešpecificky zabíjať vírusom infikované a nádorové
bunky. Tieto bunky nie sú časťou zápalovej odpovede, ale sú dôležité v
nešpecifickej imunite proti vírusovým infekciám a pri surveillance
nádorov.
Eozinofily
Eozinofily (obrázok 6a a 6b) majú v granulách proteíny, ktoré účinne
zabíjajú niektoré parazity.
FAGOCYTÓZA A INTRACELULÁRNE ZABÍJANIE
Fagocytujúce bunky
Neutrofily/Polymorfonukleárne bunky
PMNL sú pohyblivé bunky, ktoré majú laločnaté jadro. Môžu byť
identifikované na základe charakteristického jadra alebo podľa
povrchového diferenciačného antigénu označovaného CD66. Obsahujú dva
typy granúl, ktorých obsah je dôležitý pre antimikrobiálne vlastnosti
týchto buniek. Primárne alebo azurofilné granuly, ktoré sa nachádzajú
najmä v mladších PMNL, obsahujú kationické proteíny a defenziny, ktoré
môžu zabíjať baktérie; proteolytické enzýmy ako elastáza, katepsín G,
ktoré štiepia proteíny; lyzozým, ktorý rozkladá peptidoglykán bunkovej
steny a myeloperoxidázu, ktorá sa podieľa na tvorbe baktericídnych
zložiek. Druhý typ granúl sa nachádza najmä v zrelých PMNL a sú to
sekundárne alebo špecifické granuly. Obsahujú lyzozým; NADPH oxidázu,
ktorá sa podieľa na tvorbe toxických kyslíkových produktov; laktoferín,
ktorý vychytáva ióny železa a proteín viažúci B12.
Monocyty/Makrofágy
Makrofágy sú fagocytujúce bunky, ktoré majú charakteristické obličkovité
jadro. Môžu byť identifikované morfologicky alebo podľa prítomnosti
povrchového markera CD14. Narozdiel od PMNL neobsahuje granuly, ale má
veľké množstvo lyzozómov, ktoré majú obsah podobný granulám PMNL.
Odpoveď fagocytov na infekciu
Cirkulujúce PMNL a monocyty reagujú na signály nebezpečenstva (SOS signály)
vytvárané v mieste infekcie. SOS signály zahŕňajú N-formyl-metionín
obsahujúci peptidy uvoľňované baktériami, peptidy koagulačného systému,
produkty komplementu a cytokíny uvoľňované z tkanivových makrofágov, ktoré
sa stretli s baktériami v tkanive. Niektoré signály SOS stimulujú endotelové
bunky v blízkosti miesta infekcie, aby exprimovali bunkové adhézne molekuly,
ako je ICAM-1 a selektíny, ktoré sa viažu na zložky na povrchu fagocytov a
spôsobujú, že fagocyty adherujú k endotelu. Vazodilatačné látky produkované
v mieste infekcie spôsobujú uvoľnenie spojov medzi endotelovými bunkami a
fagocyty potom prechádzajú cez endotelovú bariéru „vtláčením sa“ pomedzi
endotelové bunky v procese, ktorý sa nazýva diapedéza (obr. 9). Akonáhle sa
v tkanivových priestoroch objavia niektoré signály SOS, pritiahnu fagocyty
do miesta infekcie chemotaxiou (pohyb smerom k zvyšujúcemu sa chemickému
gradientu). Signály SOS tiež aktivujú fagocyty, čo vedie k zvýšenej
fagocytóze a intracelulárnemu zabíjaniu invadujúcich (útočiacich) organizmov.
|
 Obrázok 10
Obrázok 10
Adherencia baktérií prostredníctvom receptorov |
Začiatok
fagocytózy (Obr. 10)
Fagocytujúce bunky majú na svojich bunkkových membránach celý rad
receptorov, prostredníctvom ktorých sa na bunky viažu infekčné agensy.
Tie obsahujú:
Fc receptory
Baktérie s IgG protilátkou majú na svojom povrchu exponovanú oblasť
Fc a táto časť molekuly Ig sa môže viazať na receptor na fagocytoch.
Väzba na Fc receptor si vyžaduje predchádzajúcu interakciu
protilátky s antigénom. Väzba baktérií označených IgG na Fc receptor
má za následok zvýšenie fagocytózy a aktiváciu metabolických
procesov fagocytov (respiračné vzplanutie).
Receptory pre komplement
Fagocytujúce bunky majú receptor pre tretiu zložku komplementu C3b.
Väzba baktérií viazaných s C3b na receptor na fagocytoch vedie k
zvýšeniu fagocytózy a k stimulácii respiračného vzplanutia.
Scavenger receptory
Scavenger receptory viažu široké spektrum bakteriálnych povrchov, čo
vedie k fagocytóze baktérií.
Toll-like receptory
Fagocyty majú rôzne receptory typu Toll-like receptorov (vzor
rozpoznávajúcich receptorov alebo PRR), ktoré rozpoznávajú široké
spektrum molekulárnych vzorov nachádzajúcich sa na mikroorganizmoch,
nazývaných PAMP (molekulárne vzory patogénov) na infekčných
vyvolávateľoch. Väzba infekčných vyvolávateľov prostredníctvom
Toll-like receptorov vedie k fagocytóze a uvoľneniu zápalových
cytokínov (IL-1, TNF-alfa a IL-6) z fagocytov.
|
| |
Fagocytóza
Po adherencii baktérie začne fagocyt vysúvať pseudopódie okolo baktérie.
Pseudopódiami nakoniec obklopí baktériu, pohltí ju a uzavrie do fagozómu.
Počas fagocytózy sa granuly alebo lyzozómy fagocytu spájajú s fagozómom a
vyprázdňujú do nich svoj obsah. Výsledkom je baktéria pohltená vo
fagolyzozóme, ktorý obsahuje materiál z granúl alebo lyzozómov
|
|
|
|
|
|
|
 Obrázok 11
Obrázok 11
A. Respiračné vzplanutie: od kyslíka závislé, od myeloperoxidázy nezávislé
reakcie

B. Respiračné vzplanutie: od kyslíka závislé, od myeloperoxidázy závislé
reakcie |
Respiračné vzplanutie
a intracelulárne zabíjanie
Počas fagocytózy dochádza k zvýšenej spotrebe glukózy a kyslíka, čo sa
označuje ako respiračné vzplanutie. Dôsledkom respiračného vzplanutia je, že
fagocyt produkuje množstvo zlúčenín obsahujúcich kyslík, ktoré následne
zabíjajú sfagocytované baktérie. Toto sa označuje ako vnútrobunkové (intracelulárne)
zabíjanie závislé od kyslíka. Okrem toho môžu byť baktérie usmrtené vopred
vytvorenými látkami uvoľnenými z granúl alebo lyzozómov po fúzii s
fagozómami. Toto sa označuje ako zabíjanie nezávislé od kyslíka.
Intracelulárne zabíjanie
závislé od kyslíka a nezávislé od myeloperoxidázy (Obr.11A)
Počas fagocytózy sa glukóza metabolizuje cez
Počas fagocytózy sa glukóza metabolizuje cez pentóza monofosfátový skrat
(shunt) a vzniká NADPH. Cytochróm B, ktorý bol súčasťou špecifických
granúl, sa spája s NADPH oxidázou a aktivuje ju. Aktivovaná NADPH
oxidáza používa kyslík na oxidáciu NADPH. Výsledkom je tvorba
superoxidového anionu. Časť superoxidového anionu sa premení na H2O2 a
singletový kyslík superoxid dizmutázou. Navyše superoxidový anion môže
reagovať s H2O2, čo vedie k tvorbe hydroxylových radikálov a ešte
ďalších singletových kyslíkov. Výsledkom všetkých týchto reakcií je
výroba superoxidového anionu (O2-), H2O2, singletového kyslíka (1O2) a
hydroxylového zvyšku (OH•).
Intracelulárne zabíjanie závislé od kyslíka a
závislé od myeloperoxidázy (Obr. 11B)
Po fúzii azurofilných granúl s fagozómom sa myeloperoxidáza uvoľňuje do
fagolyzozómu. Myeloperoxidáza využíva H2O2 a halogenidové ióny (najmä Cl-ň
na produkciu chlórnanu, vysoko toxickej látky. Niektoré chlórnany sa
môžu spontánne rozkladať a pritom vzniká singletový kyslík. Výsledkom
týchto reakcií je tvorba toxického chlórnanu (OCl-) a singletového
kyslíka (1O2).
Detoxikačné reakcie (Tab. 3)
PMNL a makrofágy majú prostriedky na ochranu pred toxickými
medziproduktami kyslíka. Tieto reakcie zahŕňajú dizmutáciu
superoxidového anionu na peroxid vodíka superoxid dizmutázou a premenu
peroxidu vodíka na vodu katalázou.
|
Tabuľka 3 |
|
Reakcia |
Enzým |
| H2O2 + Cl-
--> OCl- + H2O |
Myeloperoxidáza |
| OCl- + H2O
--> 1O2
+Cl- + H2O |
| 2O2 + 2H+
--> O2-
+ H2O2 |
Superoxid dizmutáza |
| H2O2 --> H2O + O2 |
Kataláza |
Intracelulárne zabíjanie
nezávislé od kyslíka (tab. 4)
Okrem mechanizmov zabíjania závislých od kyslíka, existujú vo fagocytoch
aj mechanizmy nezávislé od kyslíka: kationové proteíny (katepsín)
uvoľnené do fagolyzozómu môžu poškodiť bakteriálne membrány; lyzozým
rozkladá bunkové steny baktérií; laktoferín viaže železo, čím
ochudobňuje baktérie o túto dôležitú živinu; hydrolytické enzýmy
rozkladajú bakteriálne proteíny. Preto dokonca aj pacienti, ktorí majú
defekt v mechanizmoch zabíjania baktérií závislých od kyslíka, sú
schopní zabiť baktérie. Avšak mechanizmy zabíjania závislé od kyslíka sú
oveľa účinnejšie pri likvidácii baktérií, preto pacienti s poruchami v
týchto mechanizmoch sú oveľa náchylnejší na závažnejší priebeh infekcií.
|
Tabuľka 4
Mechanizmy intracelulárneho zabíjania nezávislého od kyslíka
|
|
Efector Molecule |
Function |
|
Kationové proteíny (vrátane katepsínu)
Lyzozým
Laktoferín
Proteolytické a hydrolytické enzýmy
|
Poškodenie mikrobiálnych membrán
Štiepi peptidoglykán bakteriálnej steny
Viaže železo a potláča tak proliferáciu baktérií
Rozkladajú usmrtené mikroorganizmy |
|
|
 Obrázok
12 Zabíjanie závislé od oxidu dusnatého Obrázok
12 Zabíjanie závislé od oxidu dusnatého |
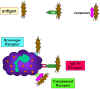
ZABÍJANIE ZÁVISLÉ NA OXIDE
DUSNATOM
Väzbou baktérií na makrofágy, konkrétne naviazanie prostredníctvom
Toll-like receptorov, vedie k tvorbe TNF-alfa, ktorý pôsobí autokrinne a
indukuje syntázu oxidu dusnatého (i-nos), a to vedie k tvorbe oxidu
dusnatého (NO) (obr. 12). Ak je bunka vystavená aj interferónu gama (IFN-gama),
bude produkovať ešte viac oxidu dusnatého (obr. 12). Oxid dusnatý
uvoľnený bunkou je toxický a môže zabíjať mikroorganizmy v blízkosti
makrofágov.
|
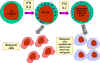 Obrázok 13
Obrázok 13
NK bunky a ich aktivácia
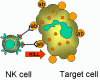 Obrázok 14
Obrázok 14
Zabíjanie opsonizovaných cieľových buniek K bunkami
|
NEŠPECIFICKÉ ZABÍJAČE (KILLER CELLS)
Niektoré typy buniek, vrátane NK a LAK buniek, K buniek, aktivovaných makrofágov
a eozinofilov je schopných zabíjať cudzie a poškodené vlastné cieľové bunky v
rámci nešpecifickej imunity. Tieto bunky hrajú dôležitú úlohu vo vrodenom
imunitnom systéme.
NK a LAK bunky
Prirodzené zabíjače (Natural Killer – NK cells) sú tiež známe ako veľké
granulárne lymfocyty (LGL), pretože sa morfologicky podobajú na lymfocyty, s
výnimkou, že sú o niečo väčšie a majú početné granuly. NK bunky môžu byť
identifikované na základe prítomnosti CD56 a CD16 a nedostatku CD3
povrchových markerov. NK bunky sú schopné zabíjať vírusom infikované a
nádorové cieľové bunky, ale sú relatívne málo efektívne. Avšak, po expozícii
IL-2 a IFN-gama sa NK bunky stávajú aktivované (lymfokínom aktivované
zabíjačské bunky – LAK), ktoré sú schopné zabíjať malígne bunky. Ak
expozícia IL-2 a IFN-gama pretrváva, potom to umožňuje LAK bunkám zabíjať
transformované aj malígne bunky. LAK bunková terapia je jedným z prístupov v
liečbe zhubných nádorov.
Akým spôsobom rozlišujú NK a LAK bunky normálne bunky od vírusom
infikovaných alebo malígnych buniek? NK a LAK bunky majú dva druhy
receptorov na svojom povrchu – aktivačné receptory KAR a inhibičné receptory
KIR. Keď KAR nájde svoj ligand – aktivačný ligand na cieľovej bunke (KAL –
killer activating ligand), NK alebo LAK bunky sú schopné takúto bunku zabiť.
Avšak receptory KIR sa tiež viažu na svoje ligandy na cieľovej bunke a za
určitých splnených podmienok inhibujú zabíjanie. Ligandami pre KIR sú
molekuly MHC I. triedy. Takže, ak cieľová bunka exprimuje normálne množstvo
MHC I. triedy, nie je takáto bunka usmrtená NK alebo LAK bunkami, hoci je
označená receptormi KAR. Normálne bunky exprimujú na svojom povrchu molekuly
MHC I. triedy, ale vírusom infikované a nádorové bunky majú zníženú expresiu
MHC I. triedy alebo ich vôbec neexprimujú. NK bunky a LAK bunky teda
selektívne zabíjajú vírusom infikované a malígne bunky, pričom normálne
bunky nezabijú.
K bunky (Obrázok 14)
Killer (K) bunky sú skôr funkčným druhom lymfocytov. K bunky dokážu
sprostredkovať ADCC reakcie (bunkami sprostredkovaná cytotoxicita závislá od
protilátky) a zničiť bunku v spolupráci s protilátkami, ktoré sú na cieľovú
bunku naviazané. Pri ADCC reakciách pôsobí protilátka ako prepojenie medzi K
bunkou a cieľovou bunkou, aby bolo možné usmrtenie cieľovej bunky. K bunky
majú na svojom povrchu Fc receptory pre protilátky a tak môžu rozpoznať,
naviazať a usmrtiť cieľovú bunku označenú protilátkami. K bunky, ktoré majú
Fc receptory zahŕňajú NK a LAK bunky, makrofágy, ktoré majú receptory pre
IgG protilátky, a eozinofily, ktoré majú Fc receptory pre IgE protilátky.
|
| |
Všetky zložky
nešpecifického imunitného systému sú modulované produktami špecifického
imunitného systému, ako sú interleukíny, interferón-gama, protilátky atď. |
|
Naučili ste sa
1. rozdiely medzi nešpecifickými a špecifickými imunitnými reakciami
2. humorálne zložky nešpecifického imunitného systému a ich
pôsobenie
3. bunkové zložky nešpecifického imunitného systému a ich
pôsobenie
4. cesty intracelulárneho zabíjania baktérií fagocytmi a ich
charakteristické vlastnosti
5. účinok humorálnych zložiek ako interferón, TNF, IL-2,
komplement atď. na bunkové zložky nešpecifickej imunity
|
|
Tabuľka 5
Charakteristické vlastnosti buniek zúčastňujúcich sa nešpecifických
imunitných reakcií
|
|
Efektorová bunka |
Identifikačné markery a/alebo
funkcia |
|
CD3 |
Ig |
Fc |
CD |
Fagocytóza |
|
Neutrofil
Makrofágy
NK
bunky
K bunky
LAK bunky
Eozinofil |
-
-
-
-
-
- |
-
-
-
-
-
- |
IgG
IgG
IgG
IgG
?
IgE |
CD67
CD14
CD56 & 16
?
?
CD67 |
+
+
-
-
?
-
|
|
|
 |
 Návrat do
sekcie Imunológia on-line v oblasti Mikrobiológie a Imunológie on-line Návrat do
sekcie Imunológia on-line v oblasti Mikrobiológie a Imunológie on-line
Page maintained by
Richard Hunt
Please report any problems to richard.hunt@uscmed.sc.edu
|

 Obrázok 4A Dva neutrofily v krvnom nátere
Obrázok 4A Dva neutrofily v krvnom nátere  Obrázok 5
Obrázok 5 Obrázok 10
Obrázok 10  Obrázok 13
Obrázok 13 















