|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGY |
IMMUNOLOGY |
MYCOLOGY |
PARASITOLOGY |
VIROLOGY |
|
VIDEO LECTURE
|
IMMUNOLOGIE -
CHAPITRE UN
IMMUNITE INNEE
(NON-SPECIFIQUE)
Gene Mayer,
Ph.D.
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Denis
Hudrisier, Ph.D.
Centre national de la recherche scientifique (CNRS) · Institute of
Pharmacology and Structural Biology
Université de Toulouse
|
|

 |
|
EN ANGLAIS -
ENGLISH |
|
EN
ESPANOL -
SPANISH |
|
EM PORTUGUES
- PORTUGUESE |
|
SHQIP - ALBANIAN |
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|
|
 |
|
Logo image
© Jeffrey Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
LECTURES:
Male
et al. Immunology
7ème édition, chapître 1, pp. 19-28, chapître 6
OBJECTIFS DU COURS
Comprendre l’importance du système immunitaire pour combattre les
infections et les maladies
Distinguer entre les systèmes immunitaires non-spécifique (inné) et
spécifique (adaptatif)
Comprendre les mécanismes de lutte contre les infections/maladies
(élimination des pathogènes)
Connaître les composants humoraux et cellulaires de l’immunité
non-spécifique
Comprendre les mécanismes d’action des composants humoraux et
cellulaires de l’immunité non-spécifique.
 Figure 1
Figure 1
Survol du système immunitaire
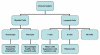 Figure 2
Figure 2
Cellules du système immunitair
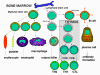 Figure 3
Figure 3
Développement des cellules du système immunitair
|
I. SURVOL DU
SYSTEME IMMUNITAIRE
En dépit d’une exposition permanente aux agents infectieux,
nous bénéficions, dans la plupart des cas, d’une remarquable résistance
aux infections. C’est notre système immunitaire qui nous permet de
résister ainsi aux infections. Notre système immunitaire est divisé en
deux grandes volets : le système immunitaire inné (ou naturel) dit non-spécifique
et le système adaptatif (ou acquis) dit spécifique (Figure 1). Le
système immunitaire inné constitue notre première ligne de défense
contre les agents infectieux alors que le système immunitaire adaptatif
agit comme une seconde ligne de défense et confère également une
protection en cas de ré-exposition au même agent pathogène. Chacun de
ces volets du système immunitaire comprend des composants cellulaires et
humoraux qui assurent les fonctions protectrices contre les pathogènes
(Figure 1). Par ailleurs, le système immunitaire inné présente des
caractéristiques qui, sur le plan anatomique, contribuent à former des
barrières contre les agents infectieux. Bien que ces deux volets de la
réponse immunitaire aient des fonctions distinctes, ils sont en fait
très interdépendants (c’est à dire que des composants de l’immunité
innée influencent le système adaptatif et vice versa).
Nos systèmes immunitaires innés et adaptatifs agissent tout deux pour
nous protéger contre des agents infectieux : ils différent néanmoins à
bien des égards. D’une part, le système immunitaire adaptatif requiert
un certain temps avant de réagir à l’invasion par un pathogène, alors
que le système immunitaire inné repose sur des moyens de défense qui,
pour la majorité d’entre eux, sont constitutivement présents à l’entrée
de l’agent infectieux et peuvent donc être très rapidement mobilisés.
D’autre part, le système immunitaire adaptatif est dit « spécifique
d’antigène » ce qui traduit le fait qu’il réagit précisément contre le
microorganisme qui a induit la réponse immunitaire. Au contraire, le
système inné n’est pas spécifique d’antigène (il est dit « non-spécifique
») et réagit de la même façon face à une grande variété de
microorganismes différents. Finalement, le système immunitaire adaptatif
présente une mémoire immunologique c’est à dire qu’il garde un «
souvenir » de l’agent infectieux et réagit plus vite lors d’une ré-exposition
à ce même agent. Le système immunitaire innée, lui, ne possède pas de
mémoire immunologique.
Les cellules de notre système immunitaire naissent dans la moelle
osseuse et se répartissent en cellules myéloïdes (neutrophiles,
basophiles, éosinophiles, macrophages et cellules dendritiques) et
lymphoïdes (lymphocytes B, lymphocytes T et cellules Natural Killer)
(Figure 2) qui se différencient selon deux voies différentes (Figure 3).
Le progéniteur myéloïde (cellule souche myéloïde) donne naissance, dans
la moelle osseuse, aux érythrocytes (globules rouges), aux plaquettes,
aux neutrophiles, monocytes/macrophages ainsi qu’aux cellules
dendritiques alors que le progéniteur lymphoïde (cellule souche
lymphoïde) donne naissance aux lymphocytes NK, T et B. Dans le cas des
lymphocytes T, le précurseur des cellules T doit migrer de la moelle
osseuse vers le thymus où il va subir une différenciation conduisant à
deux types principaux de lymphocytes T, les lymphocytes T CD4+
auxiliaires (et les lymphocytes T CD8+ pré-cytotoxiques. Deux types de
lymphocytes T auxiliaires sont produits dans le thymus, les cellules
Th1, qui aident les lymphocytes T CD8+ pré-cytotoxiques à se
différencier en lymphocytes T cytotoxiques, et les Th2, qui aident les
lymphocytes B à se différencier en plasmocytes secréteurs d’anticorps.
La fonction principale de notre système immunitaire est de distinguer
nos propres composants (le Soi) de ceux ne nous appartenant pas (le Non-Soi).
Cette capacité de discrimination du Soi et du Non-Soi est nécessaire
pour protéger notre organisme contre les agents pathogènes qui peuvent
l’envahir mais aussi contre nos cellules lorsque celles-ci ont été
modifiées (c’est à dire lorsqu’elles sont devenues malignes). Etant
donné que les agents pathogènes peuvent se répliquer à l’intérieur
(virus, certaines bactéries et parasites) ou à l’extérieur (la plupart
des bactéries, les champignons et de nombreux parasites) de nos
cellules, différents composants de notre système immunitaire ont évolué
pour nous protéger contre ces différents types de pathogènes. Il est
important de se souvenir qu’infection par un microorganisme ne rime pas
nécessairement avec maladie, dans la mesure où notre système immunitaire
sera bien souvent capable d’éliminer le pathogène avant même que la
maladie ne se déclenche. Les maladies se produisent en fait lorsque la
charge en agent infectieux est forte, quand la virulence de l’agent
pathogène est élevée ou quand notre système immunitaire est amoindri. Il
faut noter que, bien que notre système immunitaire ait le plus souvent
des effets bénéfiques, il peut aussi avoir des effets délétères. Lors de
l’inflammation, qui traduit la réponse à un microbe, on peut ressentir
un inconfort local ainsi que des atteintes collatérales aux tissus
adjacents à l’infection dus à des molécules toxiques produites par la
réponse immunitaire. Par ailleurs, la réponse immunitaire peut parfois
s’attaquer à nos propres tissus conduisant alors à une maladie
auto-immune.
|
Table 1 |
|
Immunité non spécifique |
Immunité spécifique |
|
La
réponse est antigène-indépendante |
La
réponse est antigène-dépendante |
|
La
réponse maximale est immédiate |
Il ya
un délai entre l’exposition et la réponse maximale |
|
Non
spécifique d’antigène |
Spécifique d’antigène |
|
Pas
de mémoire immunologique après exposition |
L’exposition conduit à une mémoire immunologique |
|
| |
II. IMMUNITE INNEE
(NON-SPECIFIQUE)
Les
éléments de l’immunité innée (non-spécifiques) (Table 2) sont constitués de
barrières anatomiques, de molécules secrétées ainsi que de composants
cellulaires. Parmi les barrières mécaniques de l’anatomie on retrouve la peau,
les épithéliums internes, le péristaltisme intestinal et les oscillations des
cils broncho-pulmonaires. On retrouve également des agents chimiques et
biologiques associées à ces barrières.
A. Barrières anatomiques aux infections
1. Facteurs
mécaniques
Les surfaces épithéliales forment une barrière physique très imperméable à
la plupart des agents infectieux. La desquamation de l’épithélium de la peau
permet de se débarrasser des bactéries et autres agents infectieux qui ont
adhéré aux surfaces épithéliales. Les mouvements des cils retrouvés sur
certaines surfaces épithéliales ainsi que le péristaltisme intestinal
permettent de maintenir l’aération du milieu intérieur et débarrassent le
tractus gastro-intestinal des microorganismes. L’action d’efflux joué par la
salive et les larmes permet de prévenir les infections au niveau des yeux et
de la bouche. Le piégeage des microorganismes par le mucus qui borde les
tractus respiratoire et gastro-intestinal protège également les poumons et
le système digestif des infections.
2. Facteurs chimiques
Les acides gras présents dans la transpiration inhibent la croissance
bactérienne. Le
lysozyme
et la
phospholipase
trouvés dans les larmes, la salive et les secrétions nasales peuvent casser
les parois et déstabiliser les membranes bactériennes. Les
défensines
(des protéines de bas poids moléculaire) trouvées dans les tractus
respiratoire et gastro-intestinal ont des propriétés antimicrobiennes.
Enfin, les surfactants pulmonaires agissent comme des opsonines (c’est à
dire des qu’ils favorisent la phagocytose des microorganismes par les
cellules phagocytaires).
3. Facteurs biologiques
La flore bactérienne normale de la peau et du tractus gastro-intestinal
prévient la colonisation par des bactéries pathogènes en sécrétant des
substances toxiques ou en entrant en compétition avec ces dernières pour
l’accès aux nutriments ou à l’attachement aux surfaces cellulaires de notre
organisme.
B. Barrières humorales aux infections
Les barrières anatomiques sont très efficaces pour prévenir la colonisation des
tissus par les microorganismes. Cependant, en cas de dommage tissulaire, ces
barrières peuvent être franchies et l’infection se produit alors. Une fois que
l’agent infectieux a pénétré dans nos tissus, un nouveau mécanisme de défense
immunitaire inné est alors mis en jeu, connu sous le nom d’inflammation aigüe.
Les facteurs humoraux jouent un rôle très important lors de l’inflammation, qui
se caractérise par un
oedème
et le recrutement de
cellules
phagocytaires. Ces facteurs humoraux sont trouvés dans le serum
ou se forment au site de l’infection.
1. Le
système du complément. Le système du complément est le principal facteur
humoral des défenses immunitaires non-spécifiques (voir le chapître
consacré au complément). Une fois activé, le
complément peut conduire, au niveau du site infectieux, à une augmentation
de la perméabilité vasculaire, au recrutement de phagocytes, à l’opsonisation
et l’élimination des bactéries.
2. Le système de coagulation. En fonction de la sévérité des atteintes
tissulaires, la système de coagulation peut être activé ou pas. Certains
produits du système de coagulation peuvent contribuer aux défenses
non-spécifiques du fait de leur capacité à augmenter la perméabilité
vasculaire et à agir comme des agents
chimiotactiques pour les phagocytes. De plus, certains
produits du système de coagulation ont des activités antimicrobiennes
directes. C’est le cas par exemple de la beta-lysine, une protéine produite
par les plaquettes pendant la coagulation et qui peut lyser des bactéries
Gram- en agissant comme un détergeant cationique.
3. Lactoferrine et transferrine. Ces protéines limitent la croissance
bactérienne en se liant au Fer, un nutriment essentiel pour les bactéries.
4. Interférons. Les interférons sont des protéines qui inhibent la
réplication virale dans les cellules infectées.
5. Le lysozyme. Le lysozyme casse les parois bactériennes.
6. L’interleukine-1. L’IL-1 provoque la fièvre et la production des
protéines de la phase aigüe, parmi lesquelles on retrouve des
anti-microbiens qui agissent notamment en opsonisant les bactéries.
|
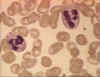 Figure 4A Deux neutrophiles sur un frottis sanguin © Bristol Biomedical
Image Archive. Utilisé avec permission
Figure 4A Deux neutrophiles sur un frottis sanguin © Bristol Biomedical
Image Archive. Utilisé avec permission
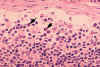 Figure 4B Histopathologie d’une lymphadenopathie due à l’infection par
le virus VIH-1. Sinus subcapsulaire. Le sinus contient un nombre accru
de neutrophiles. CDC/Dr. Edwin P. Ewing, Jr.
Figure 4B Histopathologie d’une lymphadenopathie due à l’infection par
le virus VIH-1. Sinus subcapsulaire. Le sinus contient un nombre accru
de neutrophiles. CDC/Dr. Edwin P. Ewing, Jr.
 Figure 4C
Figure 4C
Neutrophile – microscopie électronique. Notez les deux lobes nucléaires
et les granules azurophiles © Dr Louise Odor, University of South
Carolina School of Medicin
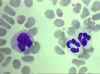 Figure 4D Frottis sanguine montrant un monocyte (gauche) et deux
neutrophiles © Bristol Biomedical Image Archive Utilisé avec permission
Figure 4D Frottis sanguine montrant un monocyte (gauche) et deux
neutrophiles © Bristol Biomedical Image Archive Utilisé avec permission
|
|
Table 2. Barrières physico-chimiques aux infections
|
|
Système/Organe |
Composant actif |
Mécanismes effecteurs |
|
Peau |
Cellules squameuses; transpiration |
Desquamation; efflux des microbes par la transpiration, acides organiques |
|
Tractus gastro-intestinal |
Cellules épithéliales cylindriques |
Péristaltisme, pH acides, sucs biliaires, efflux des microbes par les
fluides biologiques, thiocyanate |
|
Poumons |
Cils trachéaux |
Drainage mucociliaire, surfactant |
|
Nasopharynx et oeil |
Mucus, salive, larmes |
Efflux des microbes par les fluides biologiques, lysozyme |
|
Circulation et organes lymphoïdes |
Phagocytes
Cellules NK et K
Cellules LAK |
Phagocytose et mécanismes microbicides
Cytolyse directe et dépendante d’anticorps
Cytolyse dépendante de l’IL2 |
|
Serum |
Lactoferrine et Transferrine |
Liaison du Fer |
|
Interférons |
Protéines antivirales |
| TNF-alpha |
Protéine antivirale, activation des phagocytes |
|
Lysozyme |
Hydrolyse du peptidoglycane |
|
Fibronectine |
Opsonisation et phagocytose |
|
Complément |
Opsonisation, phagocytose
augmentée, inflammation |
|
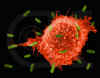 Figure
5
Figure
5
Macrophage attaquant E.coli (grossissement x8,800) ©
Dr Dennis Kunkel
(utilisé avec permission)
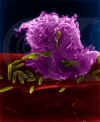 Figure 6
Figure 6
Macrophage alvéolaire (poumons) attaquant E. coli (grossissement x10,000)
©
Dr Dennis Kunkel
(utilisé
avec permission)
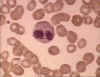 Figure 6A Eosinophile sur un frottis sanguin © Bristol Biomedical Image
Archive Utilisé avec permission
Figure 6A Eosinophile sur un frottis sanguin © Bristol Biomedical Image
Archive Utilisé avec permission
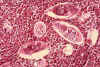 Figure 6B
Figure 6B
Histopathologie de la vessie montrant des oeufs de Schistosoma haematobium
entourés d’infiltrats riches en éosinophiles CDC/Dr. Edwin P. Ewing, Jr.
epe1@cdc.gov
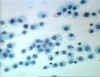 Figure 7
Figure 7
Histiocytes – Macrophages résidents à longue durée de vie trouvés dans les
tissus .
© Bristol Biomedical Image Archive Utilisé avec permission
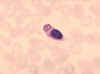 Figure 8 Monocyte ayant ingéré le parasite responsable de la malaria.
CDC/Dr. Melvin
Figure 8 Monocyte ayant ingéré le parasite responsable de la malaria.
CDC/Dr. Melvin
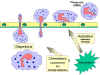 Figure
9 Réponse chimiotactique aux stimuli inflammatoires. Figure
9 Réponse chimiotactique aux stimuli inflammatoires. |
C. Barrières cellulaires aux infections
L’un des aspects de la réponse inflammatoire consiste à recruter des
polynucléaires
éosinophiles
et des macrophages sur le site infectieux. Ces cellules constituent la
principale ligne de défense du système immunitaire non-spécifique.
1. Les
neutrophiles. Les polynucléaires neutrophiles (Figure 4) sont recrutés sur
le site de l’infection où ils vont phagocyter les microorganismes et les
éliminer par des mécanismes microbicides intracellulaires. Par ailleurs, les
neutrophiles contribuent aux dommages collatéraux qui se produisent au cours
de l’inflammation.
2. Les macrophages. Les macrophages présents dans les tissus (Figures 5, 6,
7) et les monocytes nouvellement recrutés dans les tissus infectés (Figure 4
and 8) et qui vont pouvoir se différencier en macrophages, exercent
également la fonction de phagocytose et d’élimination intracellulaire des
microorganismes. De plus, les macrophages peuvent également éliminer nos
propres cellules après que celles-ci aient été infectées ou soient devenues
cancéreuses. Par ailleurs, les macrophages contribuent à la réparation
tissulaire et agissent comme des cellules présentatrices d’antigènes,
lesquelles sont requises pour la mise en œuvre des réponses immunitaires
spécifiques.
3. Les cellules Natural killer (NK) et les cellules « lymphokine activated
killer » (LAK). Les cellules NK et LAK tuent de façon non-spécifique les
cellules infectées par des virus et les cellules cancéreuses. Ces cellules
ne font pas réellement partie de la réponse inflammatoire mais elles sont
importantes lors de l’immunité non-spécifique lors d’infections virales et
pour la surveillance des tumeurs.
4. Les éosinophiles. Les éosinophiles (Figure 6a and b) possèdent des
protéines contenues dans leurs granules qui sont efficaces pour
l’élimination de certains parasites.
III. PHAGOCYTOSE ET
ELIMINATION INTRACELLULAIRE
A. Les phagocytes
1.
Neutrophiles
Les neutrophiles sont des cellules phagocytaires mobiles ayant un noyau
multi-lobé. Elles sont caractérisées par l’architecture de leur noyau mais
aussi grâce à une molécule présente à leur surface, CD66. Ils possèdent deux
types de granules, dont le contenu est impliqué dans les propriétés
microbicides de ces cellules. Les granules primaires ou
azurophiles, qui sont abondant
dans les neutrophiles nouvellement formés, contiennent des protéines
cationiques et des
défensines
qui peuvent tuer les bactéries, des enzymes protéolytiques comme l’elastase,
ou la cathepsine G qui cassent les protéines, le lysozyme qui casse les
parois bactériennes, et de façon caractéristique, la myéloperoxidase, qui
est impliquée dans génération de substances microbicides. Le deuxième type
de granules, trouvés dans des neutrophiles plus matures, sont les granules
secondaires encore appelés granules spécifiques. Ils contiennent du
lysozyme, les composants de la NADPH oxydase, impliqué dans la génération de
réactifs oxygénés toxiques, et de façon caractéristique, la lactoferrine,
une protéine de chélation du Fer et la protéine de liaison B12.
2. Monocytes/Macrophages – Les monocytes/macrophages sont des phagocytes qui
ont un noyau ayant une structure caractéristique en forme de haricot. On
peut les identifier sur le plan morphologique ou par la présence de la
molécule de surface CD14. A la différence des neutrophiles, ils ne possèdent
pas de granules mais disposent de nombreux lysosomes qui ont des contenus
similaires à ceux des granules des neutrophiles.
B. Réponse des phagocytes à l’infection
Les neutrophiles circulants et les monocytes répondent aux signaux de danger
(SOS) générés au site de l’infection. Les signaux SOS incluent les peptides
contenant la
N-formyl-methionine
produits par les bactéries, les
peptides du système de coagulation, les produits du système du complément et les
cytokines produites par les macrophages tissulaires qui ont rencontré les
bactéries dans le tissu infecté. Certains signaux du système SOS peuvent
stimuler les cellules endothéliales des vaisseaux sanguins proches du site de
l’infection ce qui les conduit à exprimer des molécules d’adhérence comme ICAM-1
ou les sélectines qui se lient à d’autes molécules d’adhérence de la surface des
phagocytes et permettent ainsi l’adhérence des phagocytes à l’endothélium. Les
vasodilatateurs produits au site de l’infection causent le relâchement des
jonctions entre cellules endothéliales et facilitent le passage des phagocytes
circulants au travers de l’endothélium par un processus appelé
diapédèse (Figure 9). Une fois dans l’espace tissulaire, les signaux
de dangers attirent les phagocytes sur le site infectieux par chimiotactisme
(mouvement permettant aux cellules de remonter un gradient de molécules
chimiotactiques). Les signaux SOS activent également les phagocytes afin de leur
permettre d’accroître leur activité de phagocytose. |
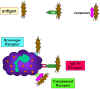 Figure 10 Liaison à des bactéries via des récepteurs
Figure 10 Liaison à des bactéries via des récepteurs |
C. Initiation de la phagocytose (Figure 10)
Les phagocytes disposent d’une variété de récepteurs présents à leur
surface par lesquels ils se lient aux agents infectieux. Ces récepteurs
incluent:
1. Les récepteurs Fc (FcR). Les bactéries recouvertes à leur surface
par des anticorps de type IgG exposent librement la partie Fc des
molécules d’anticorps qui peuvent alors se lier aux FcR présents sur le
phagocyte. La liaison des FcR nécessite donc une interaction préalable
d’un anticorps de type IgG avec un antigène de la bactérie. Cette
liaison conduit à une phagocytose accrue des phagocytes ainsi qu’à une
augmentation de l’activité métabolique du phagocyte conduisant à la
flambée (ou burst) respiratoire.
2. Récepteur au complément. Les phagocytes possèdent un récepteur pour
le 3ème composant du complément appelé C3b. La liaison de bactéries
recouvertes du fragment C3b du complément à ce récepteur conduit, là
aussi, à une phagocytose accrue des phagocytes ainsi qu’à la flambée (ou
burst) respiratoire.
3. Récepteurs « scavengers ». Les récepteurs « scavenger » se lient à
des polyanions divers et variés présents sur les surface bactériennes
permettant une augmentation de la phagocytose des bactéries.
4. Les récepteurs de la famille Toll-like (TLR, Toll-Like Receptors).
Les phagocytes possèdent une variété de Toll-like receptors (membres de
la famille plus grande encore de Pattern Recognition Receptors ou PRRs)
qui reconnaissent des motifs moléculaires très partagés (ou PAMPs,
pathogen associated molecular patterns) par de nombreux agents
infectieux. La liaison des agents pathogènes aux Toll-like receptors
conduit à l’activation des phagocytes qui vont alors produire des
cytokines inflammatoires (IL-1, TNF-alpha et IL-6).
|
| |
D. La phagocytose
Après attachement de la bactérie, le phagocyte émet des extensions membranaires
ou
pseudopodes autour de la bactérie. Les pseudopodes vont, au final, entourer
la bactérie et l’englober, la bactérie se trouvant alors inclue dans une
vésicule appelée
phagosome.
Au cours de la phagocytose, les granules ou les lysosomes du phagocyte vont
fusionner avec le phagosome. Cela conduit la bactérie à se trouver dans un
phagolysosome, au contact du contenu microbicide des granules ou des
lysosomes.
|
|
|
|
FILM
Chimotactisme de neutrophiles
Low Resolution (Quicktime)
High Resolution (Quicktime)
© Mondo Media, San Francisco, Calif., USA
and
The
MicrobeLibrary
|
FILM
Phagocytose
Quicktime
© James A. Sullivan, CellsAlive! Video, Charlottesville, Va., USA
et
The MicrobeLibrary
FILM
Phagocytosis and Bacterial Pathogens
Interactive Flash Tutorial
© Thomas M. Terry
University of Connecticut
Storrs, CT 06269 USA
and
The MicrobeLibrary |
|
 Figure 11
Figure 11
A. Flambée ou burst respiratoire: réactions oxygène-dépendante et
myéloperoxidase-indépendante
 B. Burst respiratoire: Réactions oxygène-dépendante,
myéloperoxidase-indépendante
B. Burst respiratoire: Réactions oxygène-dépendante,
myéloperoxidase-indépendante |
E. Flambée ou burst
respiratoire et élimination intracellulaire
Au cours de la phagocytose, il se produit une augmentation de la consommation de
glucose et d’oxygène, un phénomène appelé flambée ou burst respiratoire. La
conséquence de ce burst respiratoire est que des composés contenant de l’oxygène
sont produits et vont tuer les bactéries phagocytées. On parle, dans ce cas,
d’élimination intracellulaire oxygène-dépendante des pathogènes. (Figure11A)
1.
L’élimination intracellulaire oxygène-dépendante des pathogènes
Lors de la
phagocytose, le glucose est métabolisé par la voie des
pentoses monophosphate
et la NADPH est assemblée. Le
cytochrome B contenu dans les granules spécifiques des neutrophiles se
combine avec la NADPH oxydase présente à la membrane plasmique du phagocyte
et l’active. La NADPH oxydase activée utilise l’oxygène pour oxyder le NADPH.
Il s’ensuit une production d’anion superoxyde, dont une partie est
convertie, sous l’action de la superoxyde dismutase, en H202 et en oxygène
singulet. De plus l’anion superoxyde peut réagir avec l’H202 pour former des
radicaux hydoxyle et de l’oxygène singulet. Au final, ces réactions
conduisent à la formation des radicaux oxygénés toxiques (encore appelées
espèces réactives de l’oxygènes) comme l’anion superoxyde (O2-),
l’eau oxygénée H2O2, l’oxygène singulet (1O2)
et les radicaux hydroxyles (OH•).
2. Elimination intracellulaire oxygène-dependante, myélopéroxydase-dependante
des pathogènes (Figure 11B)
Lorsque les
granules azurophiles fusionnent avec le phagosome, la myélopéroxydase est
déversée dans le phagolysosome. La myélopéroxydase utilise l’H2O2
et des ions halides (en général Cl-) pour produire de l’hypochlorite, une
substance hautement toxique. Une partie de l’hypochlorite peut spontanément
conduire à la formation d’oxygène singulet. Au final, cette réaction conduit
à la production d’espèces toxiques, l’hypochlorite (OCl-) et l’oxygène
singulet (1O2).
3. Réactions de détoxification (Table 3)
Les neutrophiles et les macrophages disposent de moyens pour se protéger
contre les intermédiaires toxiques de l’oxygène qu’ils produisent. Ces
réactions mettent en jeu la
dismutation
de l’anion superoxyde en péroxyde d’hydrogène par la superoxyde dismutase
suivie de la conversion du peroxyde d’hydrogène en eau par la catalase.
|
Table 3 |
|
Réaction |
Enzyme |
| H2O2 + Cl-
--> OCl- + H2O |
Myéloperoxydase |
| OCl- + H2O
--> 1O2
+Cl- + H2O |
| 2O2 + 2H+
--> O2-
+ H2O2 |
Superoxide dismutatse |
| H2O2 --> H2O + O2 |
Catalase |
4. Elimination oxygène-indépendante des pathogènes (Table 4)
En plus des mécanismes oxygène-dépendants d’élimination intracellulaire des
pathogènes, il existe aussi des mécanismes oxygène–independants chez les
phagocytes: les protéines cationiques (cathepsine), déversées dans le
phagolysosome, peuvent endommager les membranes bactériennes; le lysozyme
casse les parois bactériennes; la lactoferrine
chélates le Fer, ce qui conduit à la déprivation des bactéries en ce
nutriment nécessaire; des enzymes hydrolytiques cassent les protéines
bactériennes. De cette façon, même les patients qui ont des défauts dans les
voies d’élimination oxygène-dépendnates des pathogènes peuvent éliminer des
bactéries intracellulaires. Néanmoins, les mécanismes oxygène-dépendants
étant bien plus efficaces, ces patients sont plus susceptibles aux
infections et développent des infections plus sévères.
|
Table 4. Mécanismes microbicides intracellulaires
indépendants de l’oxygène
|
|
Molécule effectrice |
Fonction |
|
Protéines cationiques (incluant les cathepsines) |
Dommages aux membranes microbiennes |
|
Lysozyme |
Clivage du mucopeptide dans les parois bactériennes |
|
Lactoferrine |
Déprivation en Fer des bactéries en prolifération |
|
Enzymes protéolytiques et hydrolytiques |
Digestion des organismes tués |
|
|
 Figure
12 Mécanisme microbicide dépendant de l’oxyde nitrique Figure
12 Mécanisme microbicide dépendant de l’oxyde nitrique |
IV. ELIMINATION DES PATHOGENES
DEPENDANT DE L’OXYDE NITRIQUE
La liaison de bactéries aux macrophages, notamment via les Toll-like
receptors, conduit à la production de TNF-alpha, qui agit de manière
autocrine pour induire l’expression du gène de l’ensyme iNOS-2
(inducible nitric oxide synthetase) résultant en la production d’oxyde
nitrique (NO) (Figure 12). Si la cellule est ,par ailleurs, exposée à
l’interféron gamma (IFN-gamma) davantage d’oxyde nitrique est produit
(figure 12). La production d’oxyde nitrique par la cellule est toxique
et peut tuer des microorganismes à proximité du macrophage.
|
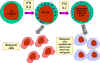 Figure 13 Les cellules NK et leur activation
Figure 13 Les cellules NK et leur activation
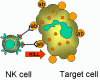 Figure 14
Figure 14
Elimination de cellules cibles opsonisées par les cellules K
|
V. CELLULES TUEUSES NON-SPECIFIQUES
Plusieurs types cellulaires différents incluant les cellules NK et LAK, les
cellules K, les macrophages activés et les éosinophiles sont capable de tuer des
cellules étrangères ou des cellules modifiées (malignes, par exemple) de façon
non-spécifique. Ces cellules jouent des rôles importants dans notre système
immunitaire inné.
A. Cellules NK et LAK
Les cellules Natural killer (NK) sont également connues sous le nom de large
granular lymphocytes (LGL) car elles ressemblent aux lymphocytes sur le plan
morphologique, à l’exception du fait qu’elles sont légèrement plus grosses et
contiennent de nombreux granules. Les cellules NK peuvent être identifiées par
la présence des molécules de surface CD56 et CD16 et l’absence du marqueur CD3.
Les cellules NK sont capables de tuer des cellules infectées par des virus
ainsiqque des cellules tumorales mais elles sont relativement inefficaces dans
ce dernier cas de figure. Toutefois, lorsqu’elles sont exposées à l’IL-2 et à
l’IFN-gamma, les cellules NK deviennent des lymphokine-activated killer (LAK),
lesquelles ont une forte activité lytique vis-à-vis des cellules malignes.
L’exposition continue à l’IL-2 et l’IFN-gamma permet aux cellules LAK de tuer
des cellules transformées aussi bien que des cellules malignes. C’est ainsi que
des approches thérapeutiques basées sur les cellules LAK sont proposées pour le
traitement des cancers.
Comment les cellules NK et LAK distinguent-elles une cellule normale d’une
cellule infectée par un virus ou d’une cellule maligne? Les cellules NK et LAK
possèdent deux sortes de récepteurs à leur surface : des récepteurs activateurs
(killer activating receptor, KAR) et des récepteurs inhibiteurs (killer
inhibiting receptor, KIR). Quand les récepteurx KAR interagissent avec leur
ligand (killer activating ligand, KAL) présent sur la cellule cible, les
cellules NK ou LAK peuvent alors détruire la cible. Cependant, si le récepteur
KIR est, en parallèle, lié à son ligand alors les cellules NK ou LAK ne peuvent
plus détruire la cible même si les récepteurs KAR sont liés au ligand KAL. Les
ligands des récepteurs KIR sont les molécules du CMH de classe I. Ainsi, si les
cellules cibles expriment les molécules du CMH de classe I à leur surface, elles
ne seront pas tuées par les cellules NK ou LAK même si les récepteurs KAR
interagissent avec leur ligand KAL. Les cellules normales expriment
constitutivement les molécules du CMH de classe I à leur surface, mais les
cellules infectées par un virus ou malignes répriment l’expression de ces
molécules. Au final, les cellules NK et LAK tuent les cellules infetcées ou
malignes mais épargnent les cellules saines ou normales.
B. Cellules K (Figure 14)
Les cellules Killer (K) ne constitue pas un type cellulaire distinct sur le plan
morphologique. On désigne plutôt par ce terme n’importe quelle cellule que ce
soit capable de médier une cytotoxicité cellulaire dépendant d’anticorps (ou
antibody-dependent cellular cytotoxicity, ADCC). Lors de l’ADCC, l’anticorps
agit en créant un lien permettant d’apposer la cellule K et la cellule cible
recouverte de l’anticorps, ce qui déclenche la cytotoxicité. Les cellules K
possèdent les récepteurs Fc (FcR) et peuvent par ce biais reconnaître, lier et
tuer les cellules recouvertes d’anticorps. Les cellules K qui ont des FcR
incluent les cellules NK, LAK, les macrophages, toutes possédant des FcR pour
les IgG et les éosinophiles, qui possèdent un FcR pour les IgE.
|
| |
Les composants
du système immunitaire non-spécifique sont modulés par des produits du
système immunitaire spécifique tels que les interleukines, l’interféron-gamma,
les anticorps etc… |
|
A présent, vous devriez connaître les points
suivants:
1. Différences entre les fonctions des systèmes immunitaires spécifiques et non-spécifiques
2. Composant humoraux de la réponse non spéciqiue et leurs actions
3. Cellules de l’immunité non spécifique et leurs fonctions
4. Mécanismes et caractéristiques de l’élimination des bactéries par les
phagocytes
5. Effets des facteurs sécrétés comme les interféron, le TNF, l’IL-2, le
complément etc... sur les cellules du système immunitaire non-spécifique
|
|
Table 5. Caractéristiques des
cellules imliquées dans la résistance non-spécifique |
|
Cellules effectrice |
Marqueur d’identification) et/ou
fonction |
|
CD3 |
Ig |
Fc |
CD |
Phagocytose |
|
Neutrophile
Macrophage
Cellule NK
Cellules K
Cellules LAK
Eosinophile |
-
-
-
-
-
- |
-
-
-
-
-
- |
IgG
IgG
IgG
IgG
?
IgE |
CD67
CD14
CD56 & 16
?
?
CD67 |
+
+
-
-
?
-
|
|
|

|
 Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
This page last changed on
Thursday, October 25, 2012
Page maintained by
Richard Hunt
Please report any problems to richard.hunt@uscmed.sc.edu
|

 Figure 4A Deux neutrophiles sur un frottis sanguin © Bristol Biomedical
Image Archive. Utilisé avec permission
Figure 4A Deux neutrophiles sur un frottis sanguin © Bristol Biomedical
Image Archive. Utilisé avec permission
 Figure
5
Figure
5 Figure 10 Liaison à des bactéries via des récepteurs
Figure 10 Liaison à des bactéries via des récepteurs Figure 13 Les cellules NK et leur activation
Figure 13 Les cellules NK et leur activation













