|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGÍA |
INMUNOLOGÍA
|
MICOLOGÍA |
PARASITOLOGÍA |
VIROLOGÍA |
|
EN INGLÉS
|
VIROLOGÍA – CAPÍTULO SEIS
VIRUS ONCOGÉNICOSDr Richard Hunt
University of South Carolina School of Medicine
Columbia
SC
USA
Traducido por :
Sarah M. Castillo -
Jorge
Medico Pasante
Clinica Corominas
Santiago
Rep. Dominicana
|
|
BUSCAR |
|
|
|
|
|
|
|
|
|
OBJETIVOS
Aprender cuáles virus pueden causar cáncer en humanos
Aprender cómo las células pueden ser transformadas por los virus
Aprender las diferencias entre los tumores de virus de ARN y los de ADN
Entender cómo los oncogenes de ARN viral provocan una transformación
celular
|
 Las
neoplasias son el resultado de una interrupción de los controles
normales de la proliferación celular. Es aparente que el número de
maneras en que puede ocurrir esta interrupción está limitado y debe de
haber al menos 40 genes en los que una mutación o alguna otra
interrupción de su expresión puede provocar una proliferación celular
descontrolada. Las
neoplasias son el resultado de una interrupción de los controles
normales de la proliferación celular. Es aparente que el número de
maneras en que puede ocurrir esta interrupción está limitado y debe de
haber al menos 40 genes en los que una mutación o alguna otra
interrupción de su expresión puede provocar una proliferación celular
descontrolada.
Hay
dos clases de estos genes en los que una expresión alterada puede llevar
al descontrol de la proliferación:
(a) Aquellos genes que estimulan el crecimiento y que pueden causar
cáncer cuando están hiperactivos. Las mutaciones de estos genes son
dominantes. Estos son los llamados oncogenes.
(b) Aquellos genes que inhiben el crecimiento celular y que causan
cáncer cuanto son desactivados. Las mutaciones de estos genes son
recesivas. Estos son los antioncogenes.
Los virus se involucran en el desarrollo de neoplasias puesto que pueden
o llevar una copia de alguno de estos genes o pueden alterar la
expresión de las copias que tiene la célula huésped de dichos genes.
|
|
Entender el descubrimiento de proto – oncogenes celulares
Aprender cómo los oncogenes celulares pueden causar cáncer en ausencia
de virus
Entender cómo estos descubrimientos llevan al descubrimiento de anti -
oncogenes
Entender cómo el descubrimiento de los anti -– oncogenes muestra la
forma en que los virus de ADN causan cáncer |
CLASES DE VIRUS TUMORALES
Existen dos
clases de virus tumorales:
-
Virus tumorales de
ADN
-
Virus tumorales de
ARN, estos últimos también llamados RETROVIRUS.
Veremos que
estas dos clases tienen diferentes maneras de reproducirse pero tienen un
aspecto en común en sus ciclos vitales: la habilidad de integrar su propio
genoma en la célula huésped. Dicha integración no es un prerrequisito para la
formación tumoral.
Si un virus
infecta un célula y altera las propiedades de la misma, se dice que ésta célula
ha sido transformada.
LA
TRANSFORMACIÓN MEDIANTE UN VIRUS PUEDE SER DEFINIDA COMO: CAMBIOS EN LAS
FUNCIONES BIOLÓGICAS QUE RESULTAN DE UNA NUEVA REGULACIÓN DADA POR GENEES
VIRALES Y QUE CONFIEREN A LA CÉLULA INFECTADA CIERTAS PROPIEDADS CARACTERÍSTICAS
DE UNA NEOPLASIA. ESTOS CAMBIOS USUALMENTE RESULTAN DE LA INTEGRACIÓN DEL GENOMA
VIRAL EN LA CÉLULA HUÉSPED.
Una
transformación generalmente implica pérdida del
control de la proliferación,
capacidad de invasión a la matriz extracelular y diferenciación. En los
carcinomas, muchas células epiteliales sufren transformaciones epitelio -
mesenquimales. Las células transformadas casi siempre exhiben aberraciones
cromosómicas.
La región
del genoma viral (AND en virus tumorales de AND o ARN en virus tumorales de ARN)
que puede causar un tumor es llamada oncogen. Este gen extraño puede ser
transportado hacia una célula y provocar que ésta adopte nuevas propiedades
tales como las de inmortalidad y proliferación independiente de anclaje.
El
descubrimiento de oncogenes virales en los retrovirus llevó a la conclusión de
que no son propios de los virus, y que genes homólogos (llamado proto –
oncogenes) son encontrados en todas las células. De hecho, es probable que el
virus haya adoptado un gen celular durante su evolución y que este gen haya
sufrido alteraciones subsecuentes. Normalmente, el pronto – encogen celular n no
es expresado en una células quiescente puesto que están involucrados en los que
es proliferación y desarrollo (lo cual no está sucediendo en todas las células
del cuerpo); si acaso, son expresados a niveles muy bajos. Sin embargo, pueden
verse expresados aberrantemente cuando la célula es infectada por un virus
tumoral que no traiga un oncogen viral consigo. Veremos luego cómo ocurre esto
pero está claro que un virus puede causar cáncer de dos maneras: Puede portar un
oncogen hacia la célula o puede activar proto – oncogenes celulares.
El
descubrimiento de los oncogenes celulares abrió las puertas para la elucidación
de los mecanismos mediante los cuales las neoplasias no inducidas por virus
pueden ser causadas. Se puede investigar la función de los productos proteínicos
de los oncogenes virales y celulares en una célula infectada y en células en las
que un proto – oncogen es expresado. Se observará que sus funciones sugieren
fuertemente mecanismos de transformación celular a fenotipos
neoplásicos. El
descubrimiento de los oncogenes celulares llevó al hallazgo de otra clase de
genes celulares, los genes supresores de tumoración o anti – oncogenes.
Inicialmente, el papel de los oncogenes virales y celulares en los tumores
causados por retrovirus era mucho más evidente que el papel de los oncogenes de
los virus tumorales de ADN pero el descubrimiento de los genes supresores de
tumores llevó a la elucidación del mecanismo de acción de los oncogenes de los
virus de ADN.
Es de notar que mientras que los virus han sido el instrumento inicial para la
elucidación de los mecanismo de oncogénesis, muchas neoplasias humanas no son
resultado de una infección por retrovirus aún cuando éstos sí son importantes en
cánceres de animales.
|

El flujo de información en los virus tumorales de ADN es similar al de
las células eucariotas.
Figura 1 |
Virus
del papiloma
Derechos reservados 1994
División de Ciencias
Veterinarias, Universidad de Queens en Belfast
|
VIRUS TUMORALES DE ADN
Los
virus tumorales de ADN pueden existir en dos formas:
En
células permisivas, todas las partes del genoma viral son expresadas.
Esto conlleva a replicación vírica, lisis celular y muerte celular
subsiguiente.
En células no permisivas, para la replicación el ADN viral es integrado
en los cromosomas celulares (generalmente) en sitios aleatorios. Tan
solo una parte del genoma viral es expresado. Las funciones de control
de fase temprana (i.e. antígenos T) del virus, son expresadas. Las
proteínas estructurales de virus no son expresadas y no se libera
ninguna progenie viral. |

Virus del papiloma
Derechos reservados
Dra. Linda M
Stannard, 1995 (usado con autorización)
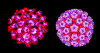
Virus del papiloma. Imagen EM coloreada con computador. Los 72
capsómeros son pentámeros de la proteína estructural principal.
Derechos reservados
Dra. Linda M
Stannard, 1995 (usado con autorización)
Figura 2 |
VIRUS TUMORALES DE ADN INVOLUCRADOS EN NEOPLASIAS EN HUMANOS
FAMILIA: Papovaviridae - Papovavirus
PAPILOMAVIRUS
Los
papilomavirus son virus causantes de verrugas que ciertamente también
causan neoplasmas humanos y causan cánceres naturales en animales.
Las
lesiones verrucoides generalmente son benignas pero pueden convertirse
en carcinomas malignos. Esto ocurre en pacientes que padecen
epidermodisplasia verruciforme. Los virus del papiloma también se
asocian a carcinomas humanos peneanos, uterinos y cervicales y lo más
probable es que sean su causa; más aún, las verrugas genitales pueden
convertirse en carcinomas.
Los
carcinomas de células escamosas de laringe, esófago y pulmón son muy
similares histológicamente a los carcinomas cervicales y pueden también
asociarse a los papilomavirus.
Existen 52 tipos descritos de papilomavirus, y aunque no obstante, no
todos están asociados con neoplasias, el 16% de todos los cánceres en
mujeres y el 10% de todos los cánceres en la población general están
asociados al papiloma.
|
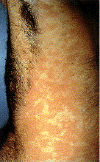
Epidermodisplasia verruciforme. Esta erupción eritematosa, marcadamente
prurítica y de amplia difusión es causada por una infección por el virus
del papiloma humano.
International Association of Physicians in AIDS Care
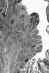
Carcinoma verrucoso. El epitelio muestra superficie de maduración,
hiperqueratosis y paraqueratosis. Hay muy poca o ninguna atipia celular.
El estroma muestra un infiltrado inflamatorio moderado crónico.
Archivo de Imágenes del The Johns Hopkins Autopsy Resource (JHAR).
Figura 3 |
Las
neoplasias vulvares, peneanas y cervicales se asocian con las cepas 16 y 18 del
virus del papiloma pero las cepas genitales más comunes del virus del papiloma
humano (VPH) son las cepas 6 y 11. Como es de esperar, si de hecho son la causa
de ciertas neoplasias, las cepas 16 y 18 provocan una transformación de los
queratinocitos humanos. En un estudio alemán, se mostró que 1 de cada 30 mujeres
infectadas con el VPH tipo 16 desarrolla una enfermedad maligna, y que 1 de cada
500 personas infectadas desarrolla una neoplasia peneana o vulvar. Puesto que no
todos los individuos infectados desarrollan cáncer, probablemente hay cofactores
estimulante de la enfermedad. Dichos cofactores han sido identificados en
carcinomas del tracto digestivo de las vacas en donde una dieta que contenga
helecho común (Pteridium aquilinum) es asociada con la patología.
NOTA, NO
OBSTANTE: EL HECHO DE QUE UN VIRUS SE ASOCIE FRECUENTEMENTE CON UN NEOPLASMA NO
PRUEBA DE NINGUNA MANERA QUE LA TRANSFORMACIÓN DE LAS CÉLULAS RESULTA POR LA
PRESENCIA DEL VIRUS. LA ASOCIACIÓN PUEDE SER CASUAL NO CAUSAL. EL EXPERIMENTO
VITAL, HECHO EN MUCHOS SISTEMAS ANIMALES, SERÍA INYECTAR EL VIRUS PURIFICADO DE
UNA TUMORACIÓN A UN HUMANO Y OBSERVAR SI EL TUMOR DESARROLLA. POR RAZONES OBVIAS,
DICHO EXPERIMENTO NO SE HA REALIZADO. A pesar de esto, los datos epidemiológicos
son muy fuertes y, en el caso del cáncer cervical en humanos, la eficacia
de las vacunas anti-VPH sostiene convincentemente que el VPH es, de hecho, causa
de cáncer cervical.
POLIOMAVIRUS
Virus del
simio No. 40
El SV 40 es un polioma virus de los monos que causa sarcomas en hámsteres
jóvenes. Fue aislado de células renales normales de mono en las que se replica.
Muchos de los que recibieron la vacuna del polio Salk en sus inicios recibieron
también SV40 porque el virus de la vacuna era cultivado en células renales de
monos. No se ha encontrado elevación en la incidencia de cáncer en estos
individuos.
Poliomavirus de los roedores
El virus polioma fue llamado así porque causa una amplia gama de tumores en
varias especies animales. Originalmente fue aislado de roedores AK y es
completamente permisivo para replicación en células de roedores. Causa leucemias
en ratas y hámsteres.
Poliomavirus humanos
Hay dos poliomas humanos aislados, conocidos como BK y JC; ninguno provino de un
tumor pero al inyectarse en animales sí causan tumor. El 70-80% de la población
es seropositiva para el JC. Este virus causa leucoencefalopatía multifocal
progresiva (véase la sección de patologías virales lentas), una enfermedad
asociada a inmunosupresión. En 1979, la tasa de incidencia de esta enfermedad
era de 1.5 por 10 millones de habitantes. Se ha hecho mucho más común por el
SIDA y se observa en 5% de todos los pacientes con SIDA. El virus BK es una
importante causa de nefropatía y fallo de injertos (transplantes) en pacientes
inmunosuprimidos receptores de transplante renal y casi todas las personas, para
la edad de 10 años, en países occidentales tienen anticuerpos anti – virus BK.
Recientemente, el ADN del virus BK fue asociado al cáncer prostático en humanos.
|
|
|
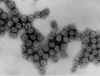
Micrografía de transmisión de electrones del poliomavirus SV40
Dr. Erskine Palmer CDC
Figura 4 |
Nota: Los poliomavirus
generalmente son líticos y si ocurre una transformación es porque el virus es
defectuoso. Luego de la integración al ADN del huésped, sólo se transcriben
a ARNm las funciones de FASE TEMPRANA y se expresan como sus productos
proteínicos. Estos son los ANTÍGENOS TUMORALES. Dado que la expresión de los
genes que codifican los antígenos tumorales es esencial para la transformación
celular, estos pueden clasificarse como ONCOGENES.
DEFINICIÓN
DE UN ONCOGEN: UN ONCOGEN ES UN GEN QUE CODIFICA UNA PROTEÍNA QUE POTENCIALMENTE
PUEDE TRANSFORMAR UNA CÉLULA NORMAL EN MALIGNA. PUEDE SER TRANSMITIDO POR UN
VIRUS EN CUYO CASO SE CONOCE COMO ONCOGEN VIRAL.
Los
antígenos tumorales del SV 40 son oncogenes
Antígeno T largo:
Necesario para la transformación de una célula a un estado canceroso
Estimula a la célula huésped a replicar su ADN
Se
encuentra en el núcleo y en la superficie celular (antígenos tumorales
específicos de transplantes)
Se
une al ADN celular
Se
une a la proteína p53 (véase debajo)
En el
polioma hay un antígeno T medio, además del antígeno T largo, que también
puede actuar como un oncogen.
Dos
aspectos importantes a tomar en cuenta sobre los antígenos T de los virus
tumorales de ADN como oncogenes:
1) Son
verdaderos genes virales. No hay homólogos celulares en las células no
infectadas.
2) Son
necesarios en las infecciones líticas dado que participan en el control de
la transcripción de ADN viral y celular.
Estas propiedades deben de ser contrastadas con los oncogenes retrovirales para
ser discutidas posteriormente.
|

Adenovirus
Derechos reservados
Dr Stephen Fuller, 1998
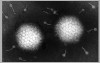
Adenovirus
Derechos reservados
Dra Linda M Stannard,
Universidad de Cape Town, Sudáfrica, 1995 (usado con autorización).
Figura 5
|
FAMILIA: Adenoviridae
ADENOVIRUS
Estos virus son altamente oncogénicos en animales y solo una porción de ellos es
integrada en el genoma de la célula huésped. Esta porción codifica para
proteínas de función temprana (la región E1A contiene los oncogenes que
codifican varios antígenos T). Ninguna neoplasia humana ha sido inequívocamente
asociada con los adenovirus. Los productos del gen E1A (proteínas no
estructurales de fase temprana) se unen a los productos del gen Rb (véase en la
secciones siguientes). Por tanto los polioma – y los adeno - -virus parecen
causar de modo similar una transformación celular: mediante la integración de
genes de función temprana en el cromosoma y la expresión de estos genes
controladores de la síntesis de ADN sin la producción de proteínas estructurales
virales.
|
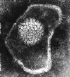
Herpes virus. Tinción negativa
Derechos reservados
Dra Linda M Stannard,
Universidad de Cape Town, Sudáfrica, 1995 (usado con autorización).

Virus Herpes Simplex con ADN encapsidado empacado en una especie de
fagosoma líquido - cristalino
(F.P.Booy, W.W.Newcomb, B.L.Trus, J.C.Brown, T.S.Baker, y A.C.Steven, en
CELL, Vol. 64 pp. 1007-1015, Marzo 8, 1991)
Virus Herpes Simplex (MET x169,920)
©
Dennis Kunkel
Microscopy, Inc.
Usado con autorización
Figura 6 |
FAMILIA: Herpesviridae
HERPESVIRUS
Existe evidencia circunstancia considerable que implica a estos virus de
ADN envueltos con neoplasmas humanos. Son altamente tumorigénicos en
animales. El genoma del virus del herpes se integra en la célula huésped
en sitios específicos y puede causar ruptura de los cromosomas u otros
daños (véase debajo). Los herpesvirus frecuentemente son co -
carcinógenos. Pueden tener un mecanismo de oncogénesis tipo “golpe y
fuga”, quizás mediante la expresión de proteínas temprano en la
infección que conllevan a la ruptura cromosómica o a otros daños. Vea
debajo.
Los
herpesvirus tienen genomas largos de más de 10 genes. Cuando estos virus
infectan células que aunque no son permisivas para la producción viral
sí se transforman, sólo un subgrupo (cerca de 9) de los genes virales
son expresados. Estos genes codifican antígenos nucleares o proteínas de
membrana. No todo este subgrupo de 9 genes asociados a transformación
celular es expresado en todas las células transformadas por herpes.
Virus Epstein-Barr (Herpesvirus humano tipo 4)
Este es el herpesvirus más fuertemente asociado a cáncer. Infecta
primariamente linfocitos y células epiteliales. En los linfocitos, la
infección es usualmente no productiva, contrario a en las células
epiteliales de las que el virus es derramado (infección productiva).
El
VEB está asociado causalmente a:
-
Linfoma de Burkitt en el trópico, en donde es más común en las
regiones en las cuales la malaria es endémica
-
Cáncer
nasofaríngeo, particularmente en China y el Sureste de Asia, en
donde ciertos componentes de la dieta pueden actuar como co -
carcinógenos
-
Linfomas de células B en individuos inmunosuprimidos (tales como los
de transplante de órgano o VIH)
-
Linfoma de Hodgkin. El VEB ha sido detectado en un alto porcentaje
de los linfomas tipo Hodgkin (casi en el 40% de los pacientes
afectados)
-
Enfermedad
linfoproliferativa ligada al cromosoma X (Síndrome de Duncan)
El
VEB puede causar linfoma en los micos titíes y pueden transformar
linfocitos B humanos in vitro.
El
VEB causa mononucleosis infecciosa, también conocida como enfermedad del
beso y/o fiebre glandular. Esta es una enfermedad auto – limitada de los
linfocitos B, los que proliferan benignamente. A menudo, la infección
pasa desapercibida (es sub – clínica) y casi la mitad de la población de
los países occidentales ha sido infectada para cuando alcanza la edad de
los 20 años. El porqué este virus causa una enfermedad benigna en
algunos individuos pero maligna en otros es desconocido.
|
|
|
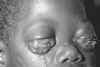 Linfoma de Burkitt causado por el virus Epstein-Barr
Imagen del Archivo del The Johns Hopkins Autopsy Resource (JHAR).
Linfoma de Burkitt causado por el virus Epstein-Barr
Imagen del Archivo del The Johns Hopkins Autopsy Resource (JHAR).
 Distribución del Linfoma
de Burkitt
Distribución del Linfoma
de Burkitt
A
 B
B
 Extendido de sangre periférica de un individuo sano (A) y el de un
paciente con mononucleosis infecciosa causada por el virus Epstein-Barr
(VEB).
(B). Ambos frotis están teñidos con tinción Giemsa
© Gloria J. Delisle y Lewis Tomalty Universidad de Queens en Kingston,
Ontario, Canadá y
The MicrobeLibrary
Extendido de sangre periférica de un individuo sano (A) y el de un
paciente con mononucleosis infecciosa causada por el virus Epstein-Barr
(VEB).
(B). Ambos frotis están teñidos con tinción Giemsa
© Gloria J. Delisle y Lewis Tomalty Universidad de Queens en Kingston,
Ontario, Canadá y
The MicrobeLibrary
Figura 7 Virus Epstein- Barr
|
| |
Citomegalovirus humanos ( Virus herpético humanos tipo 5)
Este
herpesvirus se asocia frecuentemente al sarcoma de Kapposi, aunque hoy en día se
cree que este está causado por el recién descubierto herpesvirus tipo 8.
Virus
herpético humano tipo 8 (VHH-8, Herpesvirus del Sarcoma de Kaposi)
El VHH-8 infecta
linfocitos y células epiteliales/endoteliales y es el agente causal del sarcoma
de Kaposi. También se relaciona con malignidades hematológicas, incluyendo
linfomas primarios de efusión, la enfermedad multicéntrica de Castleman, los
linfomas inmunoblásticos/plasmablásticos relacionados a la enfermedad de
Castleman, y a varios desórdenes linfoproliferativos atípicos.
El VEB y el VHH-8
se han asociado a lesiones orales y a neoplasmas en pacientes infectados con VIH.
Dentro de estas patologías está la leucoplaquia oral vellosa la cual es benigna
y causa engrosamientos blanquecinos en el epitelio lingual en donde prolifera el
virus.
Para más
información sobre los herpesvirus y las patologías que causan, refiérase al
capítulo 11 de la sección de Virología
Herpesvirus
|
| |
FAMILIA: Hepadnaviridae
VIRUS DE LA HEPATITIS B
|
Viriones de hepatitis B: 2 núcleos (cores) expuestos (indicados mediante
flechas) |
 Viriones de Hepatitis B
Viriones de Hepatitis B
 Representación
diagramática del virión de la hepatitis B y los componentes antigénicos
de su superficie
Representación
diagramática del virión de la hepatitis B y los componentes antigénicos
de su superficie
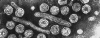 Virus de la Hepatitis B
Virus de la Hepatitis B
Figura 8
Estas 4 imágenes: Derecho reservado
Dra Linda M Stannard,
Universidad de Cape Town, Sudáfrica, 1995 (usado con autorización).
|

Esta mujer tiene hepatitis B y padece de cáncer hepático. Era una
refugiada de Camboya y murió 4 meses después de llegar al campo de
refugiados (el promedio de esperanza de vida luego de establecido el
diagnóstico de cáncer hepático es de 6 meses)
Immunization Action Coalition Cortesía de Patricia Walker, MD, Ramsey
Clinic Associates, St. Paul, MN
Figura 9 |
El virus de la hepatitis B es muy diferente a otros virus tumorales de
ADN. De hecho, aún cuando es un virus de ADN, es más parecido a los
oncornavirus (virus tumorales de ARN) en su modo de replicación. La
Hepatitis B es un problema vasto de Salud Pública y el carcinoma
hepatocelular, que es uno de los cánceres más comunes mundialmente, bien
puede ser causado por el VHB. Hay una fuerte correlación entre los
portadores crónicos del HBsAg (antígeno de superficie del virus
hepatitis B) y la incidencia de carcinoma hepatocelular. En Taiwán, se
ha demostrado que los portadores del HBsAg tienen un riesgo de padecer
de carcinoma hepatocelular 217 veces más algo que quiénes no portan el
antígeno. 51% de las muertes de portadores del HBsAg son debidas a
cirrosis hepática o a carcinoma hepatocelular, comparado al 2% de la
población general.
NOTA: El virus hepatitis B es un virus tumoral de ADN PERO tiene una
forma rara de replicación. El ADN se transcribe a ARN no sólo para la
manufactura de proteínas víricas sino también para la replicación
genómica. El ARN genómico se transcribe de nuevo a ADN genómico. Esto se
denomina TRANSCRIPCIÓN INVERSA. Esto no es típico de los virus tumorales
de ADN pero la transcripción inversa es un factor importante en el ciclo
de vida de los virus tumorales de ADN. Véase más adelante.
|
|
|
|
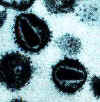
Virus de la inmunodeficiencia humana Derechos
reservados Departamento de Microbiología, Universidad de Otaga, Nueva
Zelanda.

Estructura de un retrovirus: (El virus ilustrado es el virus de la
inmunodeficiencia humana tipo 1)
Tomado de la Librería de Imágenes del Instituto del SIDA de Harvard,
cortesía del Critical Path AIDS Project, Filadelfia.
Figura 10

Replicación del retrovirus
Figura 11 |
VIRUS TUMORALES DE ARN
(RETROVIRUS)
Los
retrovirus se diferencian de los virus tumorales de ADN en que su genoma
es de ARN, pero son similares en que el genoma es integrado al de la
célula huésped.
Puesto que el ARN compone el genoma de las partículas virales maduras,
debe ser copiado a ADN antes de su integración a los cromosomas de la
célula huésped. Este estilo va en contra del dogma central de la
biología molecular que establece que ADN se copia a ARN.
Estructura de los retrovirus
La
envoltura externa viene de la membrana plasmática de la célula huésped
Las
proteínas de envoltura (antígenos de superficie) son codificadas por el
gen env (envoltura). Un producto primario del gen se sintetiza
pero es dividido de manera tal que exista más de una glicoproteína de
superficie en el virus maduro (la división se realiza mediante un enzima
de la célula huésped en el aparato de Golgi).
Dentro de la envoltura hay una cápside icosaédrica que contiene
proteínas codificadas por el gen gag (AntiGeno Grupo-
específico). Las proteínas codificadas por el gen Gag también cubren el
ARN genómico. Igual que en el anterior, sólo hay un producto primario
del gen. Este es dividido por una proteína codificada por el virus (del
gen pol)
Hay
dos moléculas de ARN genómico por partícula vírica con una chapa en el
extremo 5’ y una secuencia poli-A en el extremo 3’. Por tanto, el virus
es diploide. El ARN es de sentido positivo (igual que un ARNm).
Aproximadamente 10 copias de la transcriptasa inversa están presentes
dentro de un virus maduro, estas son codificadas por el gen pol.
El gen Pol
codifica para varias funciones (igual como sucede con los genes
gag y env, una poliproteína única es sintetizada y
luego dividida)
|

Estructura de la proteasa del Rous Sarcoma Virus unida a un péptido
análogo al sitio de división del VIH
Requiere Netscape y plug - in Chime. Descargue Chime
aquí –
Haga un click en la imagen para abrir el archivo
Figura 12 |
Los
productos del gen pol son:
a)
Transcriptasa inversa (una polimerasa que copia ARN en ADN)
b)
Integrasa (integra el genoma viral al genoma de la célula huésped)
c)
RNasa H (divide el RNA a medida que el ADN es transcrito de modo que la
transcriptasa inversa pueda sintetizar la segunda cadena complementaria
de ADN)
d)
Proteasas (dividen las poliproteínas traducidas de los ARNm de los genes
gag y pol). Nota: esta es una proteína
codificada por el virus y el blanco de una nueva generación de drogas
antivirales.
|
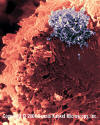
Linfocito T
humano con infección por el HTLV-1 (virus de ARN, Familia Retroviridae).
El virus es ese cúmulo grande en la esquina.
©
Dennis Kunkel
Microscopy, Inc.
Usado con autorización
Figura 13 |
GRUPOS DE RETROVIRUS
ONCOVIRINAE
Estos incluyen los virus tumorales y los de morfología similar. El
primer miembro descubierto de este grupo fue el Rous Sarcoma Virus – que
causa un neoplasma retardado en los pollos.
Los
virus de este grupo que pueden causar tumores en humanos son:
HTLV-1
(virus linfotrópico T humano tipo 1) que causa leucemia-linfoma T del
adulto (leucemia de células T de Sezary). Esta patología se encuentra
con frecuencia en algunas islas japonesas, el Caribe, América Latina y
África. El HTLV-1 es de transmisión sexual.
HTLV-2
(virus linfotrópico T humano tipo 2) que causa Leucemia de Células
Pilosas (anteriormente llamada Reticuloendoteliosis leucémica). El virus
es endémico en regiones específicas de las Américas, particularmente en
poblaciones nativas.
LENTIVIRINAE
Estos tienen un largo período latente; mayormente se asocian con
enfermedades de los mamíferos ungulados (i.e. virus Visna) sin embargo,
el VIH (antes conocido como HTLV-III) que causa SIDA pertenece a este
grupo. Está mucho más relacionado a algunos Lentivirinae que a los HTLV-I
y HTLV-II que son Oncovirinae
SPUMAVIRINAE
No
hay evidencia hasta ahora de efectos patológicos causados por estos
virus. Estableces infecciones persistentes en muchas especies animales.
Han sido aislados de primates (incluyendo humanos), reses, felinos, y
leones marinos. Las
células infectadas por spumavirus tienen un aspecto espumoso (por la
presencia de numerosas vacuolas) y usualmente forman
sincitios
de células gigantes multinucleadas. El virus espumoso del chimpancé (simio)
es el prototipo. El virus espumoso humano es una variante del virus
espumoso del simio y usualmente es adquirido a través de mordeduras de
monos.
|
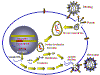
Etapas en una infección productiva de una células por un retrovirus
Figura 14 |
INFECCIÓN Y TRANSFORMACIÓN DE UNA CÉLULAS POR UN RETROVIRUS
Las
siguientes etapas se dan en el proceso de infección:
1)
Unión a un receptor de superficie células específico
2)
Engullimiento por endocitosis o por fusión directa a la membrana
plasmática. El virus podría necesitar entrar a través de un endosoma de
pH bajo antes de que pueda ocurrir la fusión aunque algunos (i.e. VIH)
pueden fusionare directamente con la membrana plasmática.
3)
El ARN (de sentido positivo) es copiado por la transcriptasa inversa a
ADN de sentido negativo. Aquí, la polimerasa actúa como una
ADN-polimerasa ARN-dependiente. Nota: la transcriptasa inversa es una
polimerasa de ADN y por tanto necesita un imprimador. Este es un ARNt
que es incorporado en la partícula vírica.
4)
El ARN es desplazado y degradado por una actividad ARNasa H codificada
por el virus. La transcriptasa inversa ahora actúa como una
ADN-polimerasa dependiente de ADN y copia los nuevos ADN en una cadena
doble de ADN. Este es el pro virus.
5)
El ADN de cadena doble es integrado en el ADN de la célula
huésped (véase más adelante) usando un enzima integrasa codificada por
el virus. Este ADN es copiado cada vez que el ADN celular es copiado.
Por tanto, en esta etapa el pro virus es como un gen celular cualquiera.
6)
Un ARN genómico (de sentido positive) en su totalidad es copiado del ADN
integrad por una ARN-polimerasa II de la célula huésped. Es chapado y
poliadenilado.
Puesto que el ARN genómico tienen el mismo sentido que el mensaje,
también actúa como un ARNm para las poliproteínas de GAG y POL.
El ARN genómico es empalmado por enzimas nucleares del huésped para
dar ARNm a otras proteínas como las de ENV. El ARN de algunos
retrovirus más complejos como el HTLV-1 y HIV sufre empalmes
múltiples (véase
las notas sobre VIH).
Nota: El ARNm viene de empalmes del ARN genómico o es el ARN genómico.
Como resultado, tanto el ARNm como el ARN genómico deben tener el mismo
sentido – y como el ARNm es de sentido positive, el ARN genómico de
todos los retrovirus también es de sentido positivo.
Una ventaja de este tipo de replicación es que permite la proliferación
en células diferenciadas puesto que la única polimerasa del huésped
usurpada por el virus es la ARN-polimerasa II que se encuentra presente
en todas las células.
|
| |
MECANISMOS DE REPLICACIÓN DEL GENOMA VIRAL
Si
la ARN – polimerasa II del huésped es usada para copiar el ADN otra vez
en ARN, hay varios problemas al tener ADN en las formas pro víricas pero
un genoma de ARN en las partículas víricas maduras.
Entre estos problemas se incluyen:
1) Que la ARN polimerasa II no copia las secuencias de control de
corriente-arriba y corriente-abajo. Solamente copia la información
necesaria para sintetizar una proteína.
2) Que la ARN polimerasa no hace corrección de errores (comprobación)
Fallo de la ARN polimerasa II en copiar el gen completo
El problema es que, al transcribir genes, la ARN polimerasa II necesita
puntos de control y reconocimiento corriente-arriba de punto de
iniciación de la transcripción. El punto corriente-arriba al que se une
la polimerasa se llama PROMOTOR. Los promotores no son copiados al ARNm
puesto que no tienen función en la traducción proteica. Luego de unirse
al promotor, la polimerasa empieza la transcripción corriente-abajo, en
un punto llamado de iniciación de ARN. La polimerasa continúa
transcribiendo el ADN en ARN hasta que llegue a una secuencia de
terminación/poliadenilación, que no es copiada en su totalidad puesto
que tampoco tiene función en la síntesis proteica. Además, los puntos
tanto corriente-arriba como corriente-debajo de la región de
transcripción, son secuencias de control que modulan la transcripción
del gen. Estos son los llamados POTENCIADORES. Estos son partes
esenciales de cualquier gen y han de estar presentes para que la ARN
polimerasa II trabaje, pero no son copiados a ARN. Esto es debido a
que la ARN polimerasa II en la célula huésped tiene la función de
sintetizar ARN mensajero el cual prescindible luego de la traducción.
Para sintetizar una proteína, la molécula de ARNm per se no necesita las
secuencias de control del gen original. Por eso, la utilización de ARN
polimerasa II de la célula huésped significa que las secuencias de
control presentes en el genoma original no estarán presentes en el
genoma de ARN de los viriones progenie.
Esto significa que la copia de ADN del genoma viral de ARN debe
integrarse al ADN del huésped corriente-debajo de un promotor en el
huésped y corriente-arriba de los puntos de terminación O debe encontrar
una manera de proveer sus propias secuencias de control (las que, como
ya mencionamos, no son copiadas al genoma de la progenie). Sucede lo
segundo de una manera muy compleja.
|
A
 Estructura de genoma de ARN de los retrovirus maduros
Estructura de genoma de ARN de los retrovirus maduros
B
 Estructura del genoma de ADN de un variante pro virus de un retrovirus.
Estructura del genoma de ADN de un variante pro virus de un retrovirus.
Figura 15 |
¿Cómo
puede un retrovirus proveer sus propios promotores de control y
potenciadores si estos no son transcritos cuando el ADN del pro virus es
copiado a su forma de ARN genómico?
He
aquí un breve (e incomplete) resumen de cómo un retrovirus puede hacer
esto:
1) El ARN viral está compuesto de tres regiones. En cada terminal
hay repeticiones (llamadas, repeticiones terminales). Las secuencias
de repetición (R) (ilustradas en verde) no codifican proteínas.
Entre dos repeticiones, hay una región única (no repetida) que
contiene los genes víricos que codifican proteínas (GAG, POL y ENV)
además de otras secuencias únicas en cualquiera de los dos
terminales que no codifican proteínas. En el terminal 5' del ARN
genómico está la región U5 y en el terminal 3' está la región U3.
PBS (en el diagrama) es el sitio de unión del imprimador. El ARNt se
una aquí cuando la transcriptasa inversa empieza a copiar. PPT es
tracto de polipurina.
|
|
VÍDEO
Formación del repeticiones terminales largas (LTR)
Requiere el plug-in de
Flash
|
2) En
la forma integrada (cuando es transcrito al ADN e insertado en el cromosoma
de la célula huésped), el pro virus es más complicado. Se encuentra que
parte de la región U3 del ARN genómico ha sido copiada y transpuesta en el
terminal opuesto del genoma. A su vez, parte de la región U5 ha sido copiada
y transpuesta en el otro terminal. Esto da al ADN integrado la estructura
mostrada en la figura 15B. Por conveniencia, sólo se muestra una sola cadena
del ADN.
Ahora, por supuesto, encontramos repeticiones terminales largas puesto que las
regiones U3 y U5 también se repiten. Las regiones U3-R-U5 son conocidas como
repeticiones terminales largas (LTRs, por su siglas en ingles). La región U3
contiene toda la información del promotor necesaria para iniciar la
transcripción del ARN en el punto de origen de la región R (repetición) mientras
que la región U5 contiene toda la información necesaria para la terminación
luego de la otra región R. Aparte de esto, las LTRs contienen información que
promueve el grado de transcripción de los tres genes retrovirales (regiones
potenciadoras). Estos potenciadotes pueden estar corriente-arriba o
corriente-debajo de la porción codificadora de proteínas de los genes.
|
| |
Transcripción de un ADN retrovírico con LTRs por la ARN polimerasa II
que resultas en la pérdida de las LTRs
Figura 16
Animación
aquí (requiere
IE) |
La ARN
polimerasa II del huésped copia el ADN del pro virus a ARN genómico que, en
adición, puede ser empalmado a ARNm. Puesto que la polimerasa empieza luego del
promotor (en U3), en el sitio de origen de la transcripción, comienza
exactamente al inicio de la región R (figura 16). Por tanto, se obtiene un copia
fidedigna (o casi totalmente fidedigna – véase debajo) del ARN que entró a la
célula. Las secuencias de terminación y la señal de poli-A están en la región
U5, que tampoco es copiada.
Debido a
este mecanismo, solo puede haber una región promotora (de U3) para los tres
genes virales, así que todos deben ser transcritos juntos. Las enzimas de
empalme, de la maquinaria de empalme de la célula huésped, cortan la primera
transcripción para formar los ARNm individuales necesarios. (Vea la
sección de VIH en
la cual esto se ha elucidado). Contrario a la situación que se tiene con los
virus tumorales de ADN, aquí no hay distinción entre funciones tempranas ni
tardías.
El lector
podría preguntare porqué, si U5 contiene regiones de terminación y
poliadenilación, la transcripción no termina simplemente al final de la primera
región R de las repeticiones terminales largas (figura 15b) y nunca llega a
genes estructurales. La región de terminación del primer U5 es reprimida,
usualmente mediante complejos mecanismos secundarios. En algunos retrovirus hay
una secuencia en el gen gag que provee el contexto para reprimir la activación
de terminación de la primera región U5. Claramente la segunda región U5 no
tiene un gen gag que le procede.
La
replicación del ARN y la síntesis de las cadenas complementarias de ADN se
llevan a cabo por la transcriptasa inversa. La transcriptasa inversa es una ADN
polimerasa ARN dependiente y, al igual que las ADN polimerasas, necesita un
imprimador. Este es un ARNt celular que es empacado dentro de la partícula
viral.
Esta
estrategia de replicación viral en la que el ARN viral primero es copiado a AND
(por la transcriptasa inversa) que luego da paso a ARNm y proteínas supone otro
problema para el virus. El paso inicial (ARN a AND) se lleva a cabo por una
enzima viral que normalmente no se encuentra en las células. Aún así este paso
de la transcripción debe de llevarse a cabo antes de la transcripción de
cualquier ARNm o de la traducción proteica. El problema se soluciona por el
virus, el cual carga cerca de 10 copias de la proteína transcriptasa inversa.
Estas fueron empacadas cuando el virus fue ensamblado en la precedente célula
huésped.
|
| |
ONCOGENES EN LOS RETROVIRUS |

Estructura típica de un retrovirus y la estructura de un retrovirus con
un oncogen (Rous Sarcoma Virus)
Figura 17
|
La
estructura ilustrada en la figura 15A y en la parte superior de la figura 17 es
aquella de un retrovirus típico con tres genes estructurales (gag, pol y env)
pero ninguno de estos es oncogénico. Si el virus ha de transformar una célula,
además de, o en vez de parte del genoma gag/pol/env, debe de tener secuencias
que alteren la síntesis celular de AND y proveer las otras funciones que son
típicas de una célula transformada. Entonces, también se encuentra un ONCOGEN
(onc) en el genoma viral de muchos retrovirus que transforman células
a neoplasia (figura17).
Definición
de transformación líricamente-inducida:
Los cambios en las funciones biológicas y en la especificidad antigénica de una
célula que resultan de la integración de secuencias genéticas virales al genoma
celular y que confieren a la célula infectada ciertas propiedades de neoplasia.
Note, no obstante, que la transformación puede ser inducida por factores
diferentes de virus i.e. carcinógenos.
¿QUÉ SON
LOS GENES ONCOGÉNICOS EN LOS RETROVIRUS?
En los
retrovirus, estos fueron descubiertos primero como un gen extra en el
Rous sarcoma virus (RSV). Este gen fue llamado src (por
sarcoma). El src no es necesario para la replicación viral. Es un
gen extra aparte de los (gag/pol/env) necesarios para la continua
reproducción del virus. El RSV tiene un genoma completo de gag/pol/env.
Supresiones/mutaciones en el src suprimen la transformación y promoción
del tumor pero el virus todavía es capaz de otras funciones. El RSV es diferente
en que ha podido manejar la retención completa de su genoma gag/pol/env.
|

Algunos retrovirus que tienen oncogen que reemplaza sus genes normales
Figura 18 |
Muy
contrario al RSV, muchos retrovirus han perdido parte de su genoma para acomodar
un oncogen (Figura 18). Esto tienen dos consecuencias:
1) La
proteína codificada por el oncogen es a menudo parte de una proteína
fusionada con otros aminoácidos virales anexos
2) El
virus debe sobrepasar el problema deque no puede replicarse en su totalidad.
Para replicar y yemar de la célula huésped necesita los productos de otro
virus, un virus ayudante.
Cerca de 40
oncogenes han sido identificados hasta ahora. Note que han sido denominados por
un código de tres letras (i.e. src, myc) que generalmente refleja el
virus del que han sido aislados. Algunos virus pueden tener más de un oncogen
(i.e. erbA, erbB). A continuación se enumeran algunos de los más
estudiados:
|
Virus |
Oncogen |
|
Rous sarcoma virus |
v-src |
|
Sarcoma virus del simio |
v-sis |
|
Virus de la eritroblastosis aviar |
v-erbA or v-erbB |
|
Virus del sarcoma en las ratas Kirsten |
v-kras |
|
Virus del sarcoma en las ratas Moloney |
v-mos |
|
Virus del mielocitoma aviar MC29 |
v-myc |
|
| |
LAS CÉLULAS TIENEN PROTO-ONCOGENES
Una
vez descubiertos los oncogenes retrovirales, una sorprendente
observación fue hecha: Contrario a la situación que se da con los
oncogenes de los virus de AND, los cuales son genes virales
verdaderos, existen homólogos de todos los oncogenes retrovirales en
células que no han sido infectadas por un retrovirus. Estos homólogos
celulares usualmente se involucran en el control del crecimiento y en la
proliferación/diferenciación y tienen importantes funciones no-transformantes
en la célula; algunos causan cáncer bajo ciertas circunstancias y,
supuestamente, aquellos que no se ha demostrado que producen cáncer
tienen la capacidad de hacerlo si se someten a las condiciones
apropiadas. Los homólogos celulares de los oncogenes virales son
llamados proto – oncogenes. Para distinguir oncogenes virales de
proto-oncogenes celulares, se les refiere como v-onc y c-onc
respectivamente. Nota: los c-oncs no son idénticos a sus v-oncs
correspondientes. Parece ser que el virus adoptó un gen de control de
crecimiento o diferenciación y, luego de adquirirlo, el gen ha sido
sujeto a mutación.
Definición de un proto-oncogen:
Un gen del huésped que es homólogo a un oncogen que se encuentra en un
virus pero que puede inducir transformación solo después de haber sido
alterado (sea por mutación o cambio en su contexto como es el pasar al
control de un promotor altamente activo). Usualmente codifica una
proteína que funciona en la replicación del ADN o en el control de
crecimiento en algún estadio del desarrollo normal del organismo.
CARACTERÍSTICAS DE LOS PROTO – ONCOGENES CELULARES
1) Estos son genes celulares típicos con secuencias de control
típicas. Y, al igual que muchos de los genes eucarióticos, muchos
tienen intrones (los oncogenes retrovirales no)
2) Muestran herencia mendeliana normal
3) Al igual que todos los genes en el genoma eucariótico, siempre
están en el mismo lugar en el genoma (cf. con lo que se esperaría de
los retrovirus endógenos que, con el tiempo, se han incorporado al
genoma celular)
4) No hay secuencias de repeticiones terminales largas (LTR) (los v-oncs
siempre están en el contexto de una LTR)
5) Los oncogenes virales son muy similares a los c-onc del animal
del que se cree que virus adquirió el gen. Por tanto, el v-src del
RSV es más parecido al src del pollo que al del humano. Nota: el v-onc
fue adquirido hace muchísimo tiempo accidentalmente por el virus del
genoma de una célula huésped previa.
6) Los oncogenes celulares son expresados por la célula en ciertos
periodos de su ciclo de vida, usualmente cuando la célula está en
crecimiento, replicación y diferenciación normal. Usualmente son
proteínas que están implicadas en el control del crecimiento.
7) Los oncogenes celulares son altamente conservados
Si
v-onc y c-onc son tan parecidos, ¿por qué cuando un virus introduce el
v-onc causa estragos en la célula? Esto se debe a diferencias en los
genes, mutaciones que han ocurrido en el gen luego de haber sido
adquirido por los virus. Estos cambios incluyen:
1) Sustitución de amino ácidos o supresiones que resultan en
productos alterados de la traducción.
2) Muchas proteínas v-onc son fusiones de proteínas traducidas de un
v-onc, híbridas de un gen de un c-onc y un gen viral.
3) Los v-oncs se insertan en el genoma del huésped junto con las
secuencias de repeticiones largas (LTRs) que contienen promotores/potenciadores.
¡Esto probablemente resulta en una sobre-expresión de un gen que se
conoce que está implicado en el control de la replicación y
transcripción de ADN!
|
| |
LOS
RETROVIRUS QUE SE TRANSFORMAN CRÓNICAMENTE NO TIENEN V-ONCs
La
observación de que un virus de transformación aguda tal como el RSV
contiene un gen extra, el oncogen, explica su alto potencial neoplásico,
pero, al contrario, los retrovirus que se transforman crónicamente solo
producen tumores lentamente y no tienen ningún gen equivalente con un v-onc.
Como mucho, tienen los tres genes virales usuales (gag/pol/env). Un
ejemplo es el virus de la leucosis aviar.
¿Cómo
es que los virus que se transforman crónicamente inducen un tumor si no
tienen oncogen?
Se descubrió que, al igual que como haría cualquier otro retrovirus, el
virus de la leucosis aviar puede integrarse en muchos sitios diferentes
del genoma celular; pero, cuando en tumores inducidos por este virus,
SIEMPRE se integra en posiciones similares (¡muy importante!). Esto
significa que el evento crucial de transformación debe de ser raro que
las células que forman el tumor han de ser clones (cf. con los de
transformación aguda que se integran en todas partes). En todos los
casos de tumor inducido por el virus de la leucosis, el genoma viral se
inserta cerca del gen celular llamado c-myc. Este es el proto –
oncogen celular, que en una variante alterada (i.e. como un v-onc), es
portado por algunos retrovirus de transformación aguda (i.e. el virus
del mielocitoma aviar que causa carcinoma, sarcomas y leucemias). Además,
el nivel de traducción del c-myc en las células transformadas por el
virus de la leucosis aviar es mucho mayor que en células no infectadas.
Por tanto, la inserción junto a un c-onc del genoma del virus de la
leucosis aviar y de otros retrovirus de transformación crónica tiene el
mismo efecto que portarlo en un v-onc.
|
Oncogénesis por inserción de promotor
Figura 19

Oncogénesis por inserción de potenciador
Figura 20 |
Entonces,
durante la integración, el virus llega para posarse corriente-arriba del c-myc
que luego bajo la influencia de promotores LTR del virus conlleva a una
sobre-expresión del c-myc. Esto se conoce como oncogénesis por
inserción de promotor (Figura 19).
Pero en
algunos tumores el virus se coloca corriente-abajo del gen c-myc.
Aunque se observó, que las LTRs, además de promotores, tienen secuencias de
potenciadores. Se conoce que estas secuencias potenciadotas pueden estar
corriente-arriba o corriente-abajo para expresarse. Esto se conoce como
oncogénesis por inserción de potenciador (Figura 20).
¿Por qué
ésta inserción cerca del c-myc es tan importante? La proteína codificada por
este gen se encuentra en el núcleo del las células normales y está implicada en
el control de la síntesis de ADN. Se puede demostrar que la sobre-expresión del
c-myc lleva rápida replicación del ADN.
|
|
A
 Muchos genes pueden asignarse a sitios específicos en los cromosomas
Muchos genes pueden asignarse a sitios específicos en los cromosomas
B
 Muchos sitios de separación en un cromosoma que están muy cercanos a un
proto-oncogen celular
Muchos sitios de separación en un cromosoma que están muy cercanos a un
proto-oncogen celular
Figura 21 |
¿PUEDEN
LOS ONCOGENES CELULARES ESTAR IMPLICADOS EN CÁNCER NO-INDUCIDO POR
VIRUS?
Una
vez demostrado que los virus pueden introducir un oncogen a la célula o
controlar un proto-oncogen celular para provocar un tumor, surgió la
pregunta de que si los proto-oncogenes celulares pueden inducir un tumor
en la ausencia de infección por retrovirus. Y la respuesta es ¡sí!
Otros reordenamientos cromosómicos pueden poner un c-onc bajo el control
de un promotor/potenciador errado (Figura 21). Por otro lado, el c-onc
puede ser mutado de manera tal que sea sobre expresado o que codifique
una proteína mutante con una función alterada.
El
mapeo o cartografía cromosómica permite precisar la localización de un
gen en un cromosoma particular y muchos cánceres asociados con
alteraciones en los cromosomas, particularmente con translocaciones (el
rompimiento de un cromosoma de forma tal que los dos fragmentos se
asocian con partes de otro cromosoma).
Muchos sitios de separación en células tumorales están muy cerca
de un c-onc conocido. ¡Esto es altamente sugestivo y es improbable que
ocurriese por casualidad!
|
Patología
|
C-onc |
translocación |
Linfoma de Burkitt * |
myc |
8 a 14 |
Leucemia mieloblástica aguda |
mos |
8 a 21 |
Leucemia mielógena crónica |
abl |
9 a 22 |
Leucemia promielocítica aguda |
fes |
15 a 17 |
Leucemia linfocítica aguda |
myb |
Supresión 6 |
Cáncer ovárico |
myb |
6 a 14 |
*
En el linfoma de Burkitt el c-myc del cromosoma 8 se transloca al
cromosoma 14 a una región próxima al gen de las cadenas pesadas de
inmunoglobulinas. Aparentemente, el proto-oncogen puede someterse al
control del promotor Ig, el cual es presuntamente muy activo en
linfocitos B. Esto explica porqué el tumor surge en células B. En
otros linfomas, un c-onc se coloca cerca del promotor de las cadenas
ligeras de inmunoglobulina. Estos también son linfomas de células
B.
El
virus de Epstein-Barr es la causa probable del linfoma de Burkitt. Este
es un herpesvirus y los herpesvirus causan separaciones cromosómicas con
frecuencia.
|
| |
¿HAY EVIENCIA DE QUE LAS MUTACIONES EN ONCOGENES CELULARES PUEDEN
TAMBIEN RESULTAR EN UNA TRANSFORMACIÓN?
La
mejor evidencia viene de los oncogenes celulares que son homólogos de
oncogenes virales encontrados en la cepa Harvey de virus de sarcoma en
roedores (el v-onc se conoce como HaRas). Este c-onc se
aisló de carcinomas vesicales y se comparó con proto-oncogenes c-onc
normales. En muchas células tumorales sólo un único cambio se ha
encontrado en la secuencia de aminoácidos de la proteína, el aminoácido
glicina fue intercambiado por valina en la posición 12. En la posición
12 solo glicina y prolina dan un crecimiento normal. Cualquier otro
aminoácido en esta posición dan una célula transformada. En carcinoma
pulmonar, el ADN transformante también contiene c-HaRas, y también
tienen una mutación puntual, en este caso en la posición 61.
|
| |
¿CUÁL
ES LA FUNCIÓN NORMAL DE LOS ONCOGENES?
Como se mencionó anteriormente, los c-oncs son genes celulares
normales que son expresados y funcionan en algunas etapas de la vida de
la célula. Se esperaría que estos estuviesen involucrados en la
síntesis de ADN o quizás en la cascada de señales que llevan a la
proliferación. Más de 40 oncogenes han sido identificados y
probablemente aún haya algunos por descubrir todavía.
Se
puede subdividir los oncogenes celulares en aquellos que codifican
proteínas nucleares y aquellos que codifican proteínas extranucleares.
Los últimos se asocian más frecuentemente con la membrana plasmática de
la célula. (Figuras 22 y 23).
Productos de los oncogenes que son proteínas nucleares:
i.e. myc, myb. Estos se implican en el control de la
expresión genética (esto es la regulación de la transcripción – son
factores de transcripción) o en el control de la replicación de ADN. Las
neoplasias se asocian con una transcripción elevada del oncogen pero una
expresión fuerte no siempre es necesaria, en vez es más necesario que el
gen esté constitutivamente activo que bajo el control de procesos
regulatorios normales.
Productos de los oncogenes que son proteínas citoplasmáticas o asociadas
a membrana:
i.e. abl, src, ras. Este tipo de oncogen no exhibe expresión
alterada pero parece que se convierte de pronto-oncogen a oncogen por
mutación. Entonces, en tumores inducidos por src, una sobre expresión
fuerte del oncogen no tiene ningún efecto.
|
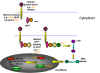
Formas en que un proto-oncogen alterado puede llevar a transformación
celular
Figura 22
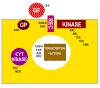
Clases de productos de proto-oncogenes celulares
GF = factores de crecimiento
REC = receptor de membrana
GP = transducers de señales de proteínas G
KINASA = tirosin kinasa asociada a membrana
CYT KINASE = proteína kinasa citoplásmica
Figura 23 |
|
FUNCIONES DE LAS PROTEÍNAS CODIFICADAS OR PROTO-ONCOGENES |
EJEMPLO |
|
Control de la transcripción de ADN (encontrada en núcleo) |
myc |
|
Señalización de unión a hormona/factor de crecimiento como la tirosina
cinasa |
src
es una tyr kinasa asociada a membrana |
|
Proteínas de unión a GTP involucradas en la transducción de señales de un
receptor de superficie al núcleo |
ras |
|
Factores de crecimiento |
sis
es una forma alterada de la cadena B del factor de crecimiento derivado de
plaquetas |
|
Receptores de factores de crecimiento |
erb-B
es un homólogo del receptor del factor de crecimiento epidérmico (también es
una tirosina cinasa). fms es un homólogo del receptor del
factor de crecimiento estimulante de colonias de macrófagos |
En cada uno de estos casos, la mutación es dominante.
Por tanto, por ejemplo si un alelo del erb-B (un homólogo del receptor
del EGF o factor de crecimiento epidérmico) es mutado de manera tal que
es constitutivamente activado (i.e. no necesita unirse a su ligando –el
factor de crecimiento epidérmico – para iniciar su actividad de tirosina
cinasa), entonces la señal está activa, sin importar que el otro alelo
esté normal. |

Las mutaciones dominantes son de ganancia de función
Figura 24A |
ANTI-ONCOGENES
(Genes supresores de tumor)
La
manera en que los retrovirus causan formación tumoral vía oncogenes se
estableció antes de que se conociera la forma en los virus tumorales de
ADN causaban tumores. Ciertamente, los virus tumorales de ADN portan
oncogenes (i.e. antígeno T SV40), pero ¿de qué manera estas proteínas,
codificadas por genes víricos verdaderos sin ningún homólogo celular,
causan la formación de tumores?
Se
conoce desde hace mucho tiempo que la mayoría de los tumores son
resultado de mutaciones dominantes, i.e. se adquiere o gana
una función que hace que la célula crezca cuando no debe (Figura 24A).
Por ejemplo, como se mencionó anteriormente, si tenemos un receptor que
emite una señal cuando se liga a un factor de crecimiento al activar su
actividad tirosina cinasa y ese receptor es mutado de forma tal que su
actividad de tirosina cinasa queda permanentemente activada, la célula
obtendrá una señal aberrante de crecimiento aún en un heterocigoto. Por
tanto, el alelo mutante es dominante sobre el alelo normal.
|
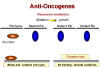
Las mutaciones recesivas son de pérdida de función
Figura 24B |
Retinoblastoma: Un tumor recesivo
Hay una
curiosa clase de tumores que no encaja en las características usuales en las que
un oncogen mutante es dominante sobre el normal.
En el
retinoblastoma, aparentemente existe una lesión que es recesiva, es decir la
mutación que causa el cáncer es de pérdida de función (Figura 24B).
(Esto es recesivo porque, en un organismo diploide, hay dos genes. Si un
alelo es mutado de forma que ya no funciona, el otro alelo puede todavía
codificar una proteína normal y su función permanece. Para que haya un pérdida
de función y que no se sintetiza ninguna proteína normal, ambos genes
deben sufrir mutación, i.e. una mutación recesiva). Por tanto, parece que la
proteína que es codificada por el gen del retinoblastoma (Rb) es una supresora de crecimiento. Si una mutación
homocigota ocurre en el gen
Rb, no habrá ningún producto Rb y la célula crecerá anormalmente porque ya no
hay un supresor de crecimiento presente. El producto del gen Rb ha sido
identificado como una proteína de 105 kDaltons ubicada en el núcleo.
Un heterocigoto para el alelo Rb todavía tiene un Rb normal y los tumores
todavía pueden ser suprimidos pero un homocigoto no tiene ningún Rb funcional y
los tumores no pueden ser suprimidos.
|
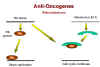 Rb y el adenovirus E1A
Rb y el adenovirus E1A
Figura 25 |
Arriba, hemos dado a notar que la proteína E1A del adenovirus (de
función temprana) está de alguna manera involucrada en la tumorigénesis.
¡Se ha encontrado que la proteína E1A en la célula
transformada-infectada por un adenovirus forma un completo con una
proteína de 105kD! Esto resulta que es el producto del gen Rb (Figura
25). Entonces, parece que el adenovirus puede causar un crecimiento
anormal celular al formar complejos (y por tanto al inactivar) una
proteína celular cuya función normal es de inhibición de crecimiento. Los tumores causados por la desactivación del producto del gen Rb son,
no obstante, bastante raros.
|
| |
p53 y cáncer en humanos
Desde las
dos últimas décadas, desde su descubrimiento en 1979, un gen conocido como el
gen p53 (denominado así por el tamaño de la proteína que codifica) ha sido
relacionado a muchos cánceres incluyendo muchos que son hereditarios. En
estos cánceres hereditarios, resulta que el gen p53 es mutante. Las
alteraciones en esta proteína parecen ser la base (directa o indirecta) de la
mayoría de los cánceres en humanos. En total, el 60% de los cánceres en
humanos implican al p53
|
Cánceres en humanos que implican al p53 |
|
Cérvix uterino |
Hígado |
|
Glándula mamaria |
Pulmón |
|
Vejiga |
Piel |
|
Próstata |
Colon |
|
| |
El 80% de
los cánceres de colon implican al gen p53
Inicialmente, se creyó que el producto del gen p53 causaba cáncer pero estudios
posteriores demostraron lo contrario, el p53 es, como el producto del gen del
retinoblastoma, un supresor de tumor. La proteína p53 ha sido llamada El Guardián del Genoma puesto que regula múltiples componentes del sistema
del control de daños del ADN.
¿Cómo
trabaja el p53 en una célula funcional? Normalmente, solo hay unas cuantas de
las molécula supresoras p53 en una célula sana y estás están en constante
rotación y recambio, pero cuando el ADN resulta dañado (sea por radiación o
mutágenos químicos) y se da la replicación, el recambio de p53 cesa. El aumento
de p53 detiene la replicación del ADN.
p53 es un
factor de transcripción.
Cuando se acumula, el p53 se une a sitio/s específico/s en lo cromosomas y
activan otros genes y estos, a su vez, detienen la mitosis. El p53 también puede
actuar de otra manera, cuando se acumula puede encaminar a la célula hacia la apoptosis. Si el p53 causa o no una detención reversible del crecimiento o
apoptosis depende del estado de activación celular; por ejemplo, un daño
extensivo no reparable del ADN puede llevar a una producción sostenida de p53
encaminando la célula a apoptosis. En casos hereditarios, hay una mutación en el
gen p53; generalmente es una mutación puntual y la proteína ya no puede unirse
en su posición correcta al ADN y por tanto no puede suprimir la replicación del
mismo.
Al igual
que el producto del gen Rb, se esperaría que el efecto del p53 sea recesivo
puesto que el otro alelo p53 es normal y debería por
tanto sintetizar una proteína funcional y suprimir la replicación de ADN como es
normal; esto es, si se es heterocigoto para la mutación – aunque, por
supuesto, sólo se está a una mutación de la carcinogénesis. Entonces, ¿por
qué las células que son heterocigotas para la mutación en p53 también tienen
problemas? Desafortunadamente, la proteína del p53 forma tetrámeros en un
arreglo en forma de listón y si la mitad de las proteínas del p53 son mutantes,
hay una gran probabilidad de que cada tetrámero tenga una molécula p53 mutante y
que esto inactive el tetrámero, un efecto negativo - dominante.
|
 p53, hepatitis C y virus del papiloma
p53, hepatitis C y virus del papiloma
Figura 26 |
Aunque
hemos aprendido bastante de familias que han heredado mutaciones en el p53, está
claro que muchas de las mutaciones del p52 se dan por factores ambientales no-hereditarios:
carcinógenos (benzopireno en el humo, aflatoxinas en el moho de maníes y maíz,
luz UV) que resultan en mutaciones puntuales. Nota: también existen mutaciones
del p53 que son de ganancia de función y llevan a tumores muy
agresivos. Esto activa genes de replicación de ADN.
¿Qué tiene
esto que ver con los virus tumorales de ADN? Tal como el producto del gen del
retinoblastoma, la presencia de un virus puede simular una mutación y extraer
los genes de supresión tumoral al formar complejos de sus formas inactivadas e
impedir su unión a sitios específicos del ADN. Esto es lo que parece que ocurre
en la hepatitis C que causa carcinoma hepatocelular. En el caso de
las células infectadas por el virus del papiloma humano, el p53 se une a
la proteína E6 y se refiere a una proteína que reconoce un sitio de separación
en el p53 y, de esa manera, lo destruye (Figura 26). Además, la proteína E7 se
une e inactiva la proteína Rb.
Nota: Con
la terapia de radiación, se creía que la radiación dañaba el ADN de las células
en división para que no pudieran dividirse más. Pero, de hecho, la radiación
sólo altera un poco el ADN lo cual no destruye la célula, pero esta pequeña
alteración es suficiente para provocar una regulación a-la-alta de la producción
del p53. Se están llevando a cabo innumerables estudios para demostrar si se
puede introducir genes p53 sanos a las células e inactivar el crecimiento
tumoral.
Así, nuestro conocimiento sobre cómo los retrovirus causan cáncer ha llevado a
la elucidación de la, antes enigmática, forma en que los virus tumorales de ADN
causaban lo mismo.
|
|
|
 Regreso a la sección de
Virologia
Microbiología e Inmunología on line
Regreso a la sección de
Virologia
Microbiología e Inmunología on line
Esta página se modificó
recientemente en
Saturday, February 07, 2015
Mantenimiento de la pagina por
Richard Hunt
|

 Las
neoplasias son el resultado de una interrupción de los controles
normales de la proliferación celular. Es aparente que el número de
maneras en que puede ocurrir esta interrupción está limitado y debe de
haber al menos 40 genes en los que una mutación o alguna otra
interrupción de su expresión puede provocar una proliferación celular
descontrolada.
Las
neoplasias son el resultado de una interrupción de los controles
normales de la proliferación celular. Es aparente que el número de
maneras en que puede ocurrir esta interrupción está limitado y debe de
haber al menos 40 genes en los que una mutación o alguna otra
interrupción de su expresión puede provocar una proliferación celular
descontrolada. 









 B
B
 Extendido de sangre periférica de un individuo sano (A) y el de un
paciente con mononucleosis infecciosa causada por el virus Epstein-Barr
(VEB).
(B). Ambos frotis están teñidos con tinción Giemsa
© Gloria J. Delisle y Lewis Tomalty Universidad de Queens en Kingston,
Ontario, Canadá y
The MicrobeLibrary
Extendido de sangre periférica de un individuo sano (A) y el de un
paciente con mononucleosis infecciosa causada por el virus Epstein-Barr
(VEB).
(B). Ambos frotis están teñidos con tinción Giemsa
© Gloria J. Delisle y Lewis Tomalty Universidad de Queens en Kingston,
Ontario, Canadá y
The MicrobeLibrary
 Viriones de Hepatitis B
Viriones de Hepatitis B












 Rb y el adenovirus E1A
Rb y el adenovirus E1A  p53, hepatitis C y virus del papiloma
p53, hepatitis C y virus del papiloma 







