|
|
|
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGÍA |
INMUNOLOGÍA
|
MICOLOGÍA |
PARASITOLOGÍA |
VIROLOGÍA |
|
ENGLISH |
VIROLOGÍA – CAPÍTULO ONCE
HERPES VIRUS Dr Richard Hunt
Professor of Pathology, Microbiology and Immunology
University of South Carolina School of Medicine
Traducido por :
Sarah M. Castillo - Jorge
Clinica Corominas
Santiago, Rep. Dominicana
|
|
ALBANIAN |
|
TURKISH |
|
BUSCAR |
|
Let us know what you think
FEEDBACK |
|
Logo image © Jeffrey Nelson, Rush
University, Chicago, Illinois and
The MicrobeLibrary |
| |
|
Mercutio (a Romeo) en Romeo y Julieta de Shakespeare:
Recorre los
labios de las damas, y les hace soñar besos,
Labios que suele ulcerar la colérica Mab,
Pues su aliento está mancillado por los dulces.
A veces galopa sobre la nariz de un cortesano
y le hace soñar que huele alguna recompensa;
y a veces acude con una parte de la colita de un cerdo
y en la nariz de un cura dormido produce un sabroso cosquilleo…
|
|
|
|
 FIGURA
1
Clasificación de los Virus Herpes
FIGURA
1
Clasificación de los Virus Herpes |
Introducción
Los herpesvirus son la principal causa de enfermedad viral en humanos, después
sólo de los virus e la influenza y del resfriado común. Son capaces de producir
una enfermedad manifiesta o permanecer silentes por muchos años únicamente para
ser reactivados luego, por ejemplo como ‘culebrilla’ (zoster). El término herpes
viene del latín herpes que, a su vez, viene del vocablo griego herpein
que significa trepar. Esto refleja la naturaleza trepadora o arrastrante de las
lesiones cutáneas causadas por muchos tipos de herpesvirus.
Existen por
lo menos 25 virus en la familia Herpesviridae (actualmente dividida en tres sub-familias).
Ocho o más tipos de herpesvirus se conocen que infectan a los humanos
frecuentemente (tabla 1 y 2, figura 1).
|
|
FIGURA
2
(debajo)
Estructura del Herpes virus
 Estructura del Virus Herpes. Entre la nucleocápside y la membrana se
encuentra el mal-definido tegumento
Estructura del Virus Herpes. Entre la nucleocápside y la membrana se
encuentra el mal-definido tegumento
 Virus Herpes Simplex-1 Cápside de Críomicroscopía de electrones con
escan de puntos
© 1994 Zhou et al. Colegio de Medicina de Baylor
Virus Herpes Simplex-1 Cápside de Críomicroscopía de electrones con
escan de puntos
© 1994 Zhou et al. Colegio de Medicina de Baylor
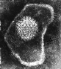 Virus herpes simplex. Tinción negativa.
Derechos reservados
Dra. Linda M
Stannard, Universidad de Cape Town, Sudáfrica, 1995 (usado
con autorización)
Virus herpes simplex. Tinción negativa.
Derechos reservados
Dra. Linda M
Stannard, Universidad de Cape Town, Sudáfrica, 1995 (usado
con autorización) |
|
TABLA 1 TIPOS DE HERPES VIRUS QUE INECTAN HUMANOS |
|
Virus Herpes simplex Tipo 1 (VHS-1) |
|
Virus Herpes simplex Tipo 2 (VHS-2) |
|
Virus Epstein Barr (VEB) |
|
Citomegalovirus (CMV) |
|
Virus Varicela Zoster (VVZ) |
|
Herpesvirus humano 6 (exantema o roseola infantil) |
|
Herpesvirus humano 8 (Virus herpético asociado al sarcoma de Kaposi) |
Una vez
un paciente ha sido infectado por un herpesvirus, la infección permanece de
por vida. La infección inicial puede ser seguida de latencia con
reactivación subsiguiente. Los herpesvirus infectan la mayor parte de la
población humana y las personas que viven luego de la mediana edad
usualmente tienen anticuerpos a la mayoría de los herpesvirus mencionados a
excepción del HVH-8.
Los
herpes virus se clasifican por su localización en la fase latente (tabla 2).
|
 Empacado tipo fagosoma líquido-cristalino del AND encapsidado en un Virus de
Herpes Simplex
(F.P.Booy, W.W.Newcomb, B.L.Trus, J.C.Brown, T.S.Baker, y A.C.Steven, en
CELL, Vol 64 pp. 1007-1015, Marzo 8, 1991)
Empacado tipo fagosoma líquido-cristalino del AND encapsidado en un Virus de
Herpes Simplex
(F.P.Booy, W.W.Newcomb, B.L.Trus, J.C.Brown, T.S.Baker, y A.C.Steven, en
CELL, Vol 64 pp. 1007-1015, Marzo 8, 1991)
 Reconstrucción tridimensional de micrografías críoelectrónicas de
cápsides de virus herpes simples. Imagen rotacional.
National Institutes of Health
Reconstrucción tridimensional de micrografías críoelectrónicas de
cápsides de virus herpes simples. Imagen rotacional.
National Institutes of Health
 Herpesvirus (particular completa) realizada por microscopía
críoelectrónica y reconstrucción de imagen versión MPEG
Herpesvirus (particular completa) realizada por microscopía
críoelectrónica y reconstrucción de imagen versión MPEG
 Herpesvirus tienen una envoltura rodeando la cápside icosaédrica,
aproximadamente 100nm de diámetro, que contiene el genoma de ADN de
cadena doble. Cuando la envoltura se rompe y se separa de la cápside,
los viriones con tinción negativa tienen una apariencia típica de “huevo
frito”.
Derechos reservados
Dra. Linda M
Stannard, Universidad de Cape Town, Sudáfrica, 1995 (usado
con autorización)
Herpesvirus tienen una envoltura rodeando la cápside icosaédrica,
aproximadamente 100nm de diámetro, que contiene el genoma de ADN de
cadena doble. Cuando la envoltura se rompe y se separa de la cápside,
los viriones con tinción negativa tienen una apariencia típica de “huevo
frito”.
Derechos reservados
Dra. Linda M
Stannard, Universidad de Cape Town, Sudáfrica, 1995 (usado
con autorización) |
|
TABLA 2 – Propiedades de los Herpes virus |
|
Tipo de herpes virus humano |
Nombre |
Sub Familia |
Tipo celular atacado |
Latencia |
Transmisión |
| 1 |
Virus Herpes simplex-1 (VHS-1) |
Alphaherpesvirinae |
Mucoepitelio |
Neuronal |
Contacto cercano |
| 2 |
Virus Herpes simplex-2 (VHS-2) |
Alphaherpesvirinae |
Mucoepitelio |
Neuronal |
Contacto cercado usualmente sexual |
| 3 |
Virus Varicela zoster (VVZ) |
Alphaherpesvirinae |
Mucoepitelio |
Neuronal |
Contacto o vía respiratoria |
| 4 |
Virus Epstein-Barr (VEB) |
Gammaherpesvirinae |
Linfocitos B, epitelio |
Linfocitos B |
Saliva |
| 5 |
Citomegalovirus (CMV) |
Betaherpesvirinae |
Epitelio, monocitos, linfocitos |
Monocitos, linfocitos y posiblemente otros |
Contacto, transfusiones sanguíneas, trasplantación, congénito |
| 6 |
Virus Herpes linfotrópico |
Betaherpesvirinae |
Linfocitos T y otros |
Linfocitos T y otros |
Contacto, ruta respiratoria |
| 7 |
Virus Herpes Humano-7 (VHH-7) |
Betaherpesvirinae |
Linfocitos T y otros |
Linfocitos T y otros |
Desconocida |
| 8 |
Virus herpes Humano-8 (VHH-8)
Herpesvirus asociado al sarcoma de Kaposi (VHSK) |
Gammaherpesvirinae |
Células endoteliales |
Desconocida |
¿Intercambio de fluidos corporales? |
|
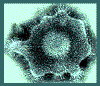 ”Espinas” glicoproteicas en la superficie del VHS. Se visualiza claramente
la Glicoproteína B (gB) en cúmulos de espinas de 10nm de longitud. Entre la
cápside y la envoltura hay una capa proteica mal definida, conocida como
tegumento.
Derechos reservados
Dra. Linda M Stannard,
Universidad de Cape Town, Sudáfrica, 1995 (usado con autorización)
”Espinas” glicoproteicas en la superficie del VHS. Se visualiza claramente
la Glicoproteína B (gB) en cúmulos de espinas de 10nm de longitud. Entre la
cápside y la envoltura hay una capa proteica mal definida, conocida como
tegumento.
Derechos reservados
Dra. Linda M Stannard,
Universidad de Cape Town, Sudáfrica, 1995 (usado con autorización)
|
Estructura del Virus Herpes – Generalidades
Envoltura
Los herpes virus son virus envueltos. Yeman de la membrana nuclear interna que
ha sido modificada por la inserción de glicoproteínas del herpes (en el virus
maduro, estas glicoproteínas determinan la célula a infectar por la
disponibilidad de receptores apropiados). La membrana viral es bien frágil y un
virus con una membrana dañada no es infeccioso (Esto significa que el virus
inmediatamente se desintegra por tanto el virus solo puede contagiarse por
contacto directo con superficies mucosas o con secreciones de una persona
infectada – no puede contagiarse de asientos de inodoros). Aparte de la
resequedad, el virus también es sensible a ácidos, detergentes y solventes
orgánicos como es de esperarse de un virus con una membrana lipídica.
Tegumento
El espacio entre la envoltura y la cápside es el tegumento. Este contiene
proteínas codificadas por el virus y enzimas involucradas en la iniciación de la
replicación
Cápside
Estos virus tienen capsómeros con forma de rosquilla de 100-200 nm de diámetro
con una nucleocápside icosaédrica. Esta última contiene 162 capsómeros
Genoma
Estos virus tienen AND de doble cadena. El tamaño de los genomas difiere con los
citomegalovirus que tienen genoma más largo.
|
|
FIGURA
3
(debajo)
Genoma de los herpes virus
 Genomas de los herpes virus. VHS, VVZ y CMV tienen secuencias repetidas
invertidas. Esto resulta en la formación de más de un isómero por
recombinación. Puesto que el VVZ tiene dos repeticiones inversas, sólo puede
formar dos formas isoméricas. Repeticiones directas no permiten la
recombinación y por eso el VEB y el VHH6 solo tienen una isoforma.
Genomas de los herpes virus. VHS, VVZ y CMV tienen secuencias repetidas
invertidas. Esto resulta en la formación de más de un isómero por
recombinación. Puesto que el VVZ tiene dos repeticiones inversas, sólo puede
formar dos formas isoméricas. Repeticiones directas no permiten la
recombinación y por eso el VEB y el VHH6 solo tienen una isoforma.
|
Replicación de los herpes virus
i)
Fijación a la superficie celular: Al igual que con muchos otros virus,
el tropismo celular está determinado por la disponibilidad de los
receptores adecuados en la superficie de la célula a ser infectada. El
virus de fija a la membrana celular a un pH ambiente y por tanto cabe la
posibilidad de la formación de sincitios entre las células infectadas y
de transmisión de célula a célula aún en la presencia de anticuerpos
humorales neutralizantes. Esto significa que la inmunidad mediada por
células es importante en la supresión de infecciones por herpesvirus.
ii) Entrada de la nucleocápside al citoplasma: La nucleocápside rodeada
de tegumento es transportada a la membrana nuclear a la que se une. El
genoma de ADN entra al núcleo.
iii) Transcripción: Este es un proceso muy complejo, como es de
esperarse por el gran tamaño del genoma. Hay tres clases de proteínas
que necesitan sintetizarse para la producción de un virus maduro.
-
Alfa proteínas: Estas son las proteínas inmediatas tempranas.
Involucradas en la regulación de la transcripción y que no se
encuentran en el virión maduro. También implicadas en el control de
la síntesis de beta proteínas (figura 4)
|
|
|
|
FIGURA
4
Expresión genética de los Herpes virus
 Expresión de los genes tempranos inmediatos, tempranos y tardíos de los
herpesvirus
Expresión de los genes tempranos inmediatos, tempranos y tardíos de los
herpesvirus
FIGURA 5
Maduración de los virus herpes
 Etapas en la exocitosis del herpes virus desde el núcleo, en donde se
ensambla el núcleo (core) viral, hacia la membrana plasmática
Etapas en la exocitosis del herpes virus desde el núcleo, en donde se
ensambla el núcleo (core) viral, hacia la membrana plasmática
|
·
Beta proteínas. Estas son las proteínas tempranas y están implicadas también
en la replicación de ADN (entre estas se incluyen la ADN polimerasa y los
factores de transcripción). Solo unas cuantas copias de la ADN polimerasa
son necesarias para que ocurra la replicación (figura 4).
·
Gamma proteínas. Estas son las proteínas de fase tardía y son componentes
estructurales del virus. La síntesis de gamma proteínas comienza después del
inicio de la síntesis de ADN (figura 4).
iv)
Transcripción de ARN: El ADN herpético se transcribe a ARN por una
enzima celular (ARN polimerasa I ADN-dependiente). No obstante, la
transcripción de varios genes es dependiente tanto de factores nucleares
de la célula como de proteínas codificadas por el virus. Este control
del ARNm viral, y por tanto, de la síntesis de proteínas virales,
determina si la infección propagará la producción de nuevas partículas
víricas y de muerte celular (una infección lítica), una descamación
continua del virus (infección persistente) o latencia. El que ocurra o
no la latencia es propiedad de la célula huésped, eso es, algunas
células no permiten la replicación del ADN viral. Si la célula permite
la progresión más allá de las etapas de los genes tempranos inmediatos,
sobreviene una infección lítica.
v)
Síntesis de ADN: Los Herpes virus codifican su propia ADN polimerasa
dependiente de ADN. Además, algunos herpesvirus codifican enzimas (como
la timidina cinasa) que permite al mismo crecer en células que no están
en división y que por tanto no contienen los precursores de la síntesis
de ADN. Sin esta enzima, los herpesvirus neurotrópicos no pudieran
replicarse dada la poca cantidad de precursores de ADN en las células
nerviosas.
vi)
Ensamblaje: Las nucleocápsides son ensambladas en el núcleo y se
rellenan con ADN. Luego yeman a través de la doble membrana nuclear y
dejan la célula mediante exocitosis o yeman a través de otra membrana
celular como la membrana plasmática (figura 5).
|
|
FUENTES EN LA RED
(en inglés)
Representación esquemática del virus herpes simplex - animación
Requiere Flash
Representación esquemática de los genes/proteínas involucrados en la
infección del virus herpes simplex - animación
Requiere Flash
|
Virus Herpes simplex (VHS)
(figura
6)
Estos
son virus muy grandes y su genoma codifica por lo menos 80 proteínas. Muchas
de esas proteínas (casi la mitad) no están directamente implicadas en la
estructura viral o en el control de su replicación pero funcionan en la
interacción con la célula huésped o con la respuesta inmune del huésped.
Hay dos
tipos, VHS-1 y VHS-2 con características muy similares
El
genoma de los VHS también codifica un número de enzimas:
·
ADN polimerasa ADN-dependiente
·
Timidina cinasa (fosforila timidina y otros nucleósidos)
·
Ribonucleótido reductasa (convierte ribonucleótidos a desoxirribonucleótido)
·
Serina-proteasa (convierte una proteína de andamiaje a su forma final) (figura
7)
El
genoma codifica 11 glicoproteínas de superficie. Estas se involucran en los
procesos de:
Adhesión (gB, gC, gD y gH)
Fusión
de la membrana viral con la de la célula huésped (gB)
Escape inmune y otras funciones (gC, gE y gI). Un ejemplo de la función de
escape inmune es gC que se une a la proteína C3 del complemento depletando
así el suero del huésped de ésta e inhibiendo reacciones mediadas por
complemento. Las proteínas gE y gI del virus también pueden unirse IgG vía
la porción Fc de la inmunoglobulina. Esto cubre al virus con
inmunoglobulinas y lo esconde del sistema inmune.
|
FIGURA 6
Virus herpes simplex – Micrografía de electrones
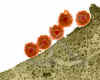 Virus Herpes Simplex (MTE x169,920)
Derechos reservados
Dr. Dennis Kunkel
(usado con autorización)
Virus Herpes Simplex (MTE x169,920)
Derechos reservados
Dr. Dennis Kunkel
(usado con autorización)
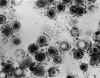 Micrografía de transmisión de electrones del virus herpes simplex. Algunas
nucleocápsides están vacías, mostradas por penetración de tinción electro-densa.
CDC/Dr. Erskine Palmer
Micrografía de transmisión de electrones del virus herpes simplex. Algunas
nucleocápsides están vacías, mostradas por penetración de tinción electro-densa.
CDC/Dr. Erskine Palmer
|
Figura
7
 La serina proteasa del herpes virus. Haga clic en la imagen a la izquierda
para vincular con una estructura interactiva de la proteasa del
citomegalovirus. Esta proteasa es esencial para la producción de los
viriones infecciosos maduros, puesto que realiza el procesamiento
proteolítico de un precursor de proteína de ensamblaje viral. (Requiere un
plug-in Chime. Adquiera Chime
aquí)
La serina proteasa del herpes virus. Haga clic en la imagen a la izquierda
para vincular con una estructura interactiva de la proteasa del
citomegalovirus. Esta proteasa es esencial para la producción de los
viriones infecciosos maduros, puesto que realiza el procesamiento
proteolítico de un precursor de proteína de ensamblaje viral. (Requiere un
plug-in Chime. Adquiera Chime
aquí) |
Replicación del VHS
Casi
cualquier tipo de célula humana puede ser infectada por un VHS. En muchas
células, como las endoteliales y fibroblastos, la infección es lítica pero las
neuronas generalmente soportan una infección latente.
Fijación
El paso inicial de la interacción del virus con la célula es la fijación al
proteoglicano, heparan sulfato. Esta molécula se encuentra en la superficie de
muchas células.
Fusión
Luego de la fijación, el virus se funde directamente con la membrana plasmática
(no es necesaria la entrada a través de endosomas/lisosomas de pH bajo). Luego
de que ocurre la fusión, el virus libera algunas proteínas al citoplasma. Entre
estas se incluyen algunas toxinas, una proteína cinasa y un iniciador de la
transcripción genética.
Síntesis
proteica
Los genes de la etapa temprana inmediata son los que primero se transcriben y
promueven la transcripción de genes de etapa temprana. Si la infección ha de ser
latente, los únicos ARNm que se sintetizan son las transcripciones
latencia-asociadas. Los productos de los genes de fase temprana incluyen la ADN
polimerasa además de enzimas que degradan las proteínas y los ARNm celulares. Si
se sintetizan proteínas tempranas y tardías, la célula se enfrasca en la ruta de
la lisis.
Como se
mencionó anteriormente, solo unas cuantas proteínas de ADN polimerasa necesitan
sintetizarse para la replicación del ADN viral. En principio, se sintetizan
concatómeros circulares pero luego la síntesis pasa a cadenas lineales de
moléculas individuales que con separadas en monómeros. Esto ocurre por un
mecanismo de rodillos (vea lectura). Los genes de fase tardía son luego
transcribidos en grandes cantidades, probablemente impulsados por la síntesis de
ADN. Son traducidos en el citoplasma y transportados de nuevo hacia el núcleo en
donde se ensamblan en la procápside. Esta última es rellenada con AND viral.
Síntesis de
glicoproteínas
Todas las glicoproteínas se sintetizan en el retículo endoplásmico rugoso en
donde reciben cadenas ricas en azúcar manosa. Las glicoproteínas son llevadas a
la membrana nuclear, probablemente por un proceso de difusión puesto que la
membrana del retículo endoplásmico es continua con la membrana nuclear externa.
Se desconoce cómo la proteína sobrepasa los poros nucleares. Luego las
nucleocápsides yeman a través de la membrana nuclear mediante áreas en las
cuales las proteínas virales están muy concentradas. De alguna manera, el virus
entra en el proceso de exocitosis luego de ser modificado en el cuerpo de Golgi
en donde recibe cadenas de sacarosas características de proteínas procesadas en
el cuerpo de Golgi (es decir, que contienen galactosa y ácido siálico).
Liberación del virus
Parecen que se dan varios mecanismos. El virus puede proceder a lo largo de una
vía de exocitosis o puede entrar al citoplasma y ser liberado mediante lisis
celular. También parece ser capaz de pasar por comunicaciones intercelulares y
así pasar de célula a célula.
|
| |
Patogénesis
El sello
distintivo de una infección por herpes es la habilidad de infectar células
mucosas epiteliales o linfocitos. Luego el virus viaja a través de nervios
periféricos a una neurona nucleada en donde puede permanecer por años y luego
reactivarse. Un área eritematosa precede a una mácula que se endurece para
formar una pápula. El líquido en esta ampolla está impregnado de virus. Siempre
y cuando el virus se mantenga húmedo puede seguir siendo infeccioso.
Los Herpes
simplex 1 y 2 pueden infectar tanto a humanos como a otros animales pero sólo
los humanos presentan síntomas de enfermedad. Como se mencionó antes, los VHS-1
y VHS-2 primero infectan células del mucoepitelio o entran a través de heridas.
Luego usualmente establecen infecciones latentes en células neuronales. El sitio
de infección inicial depende de la manera en la que el paciente adquiere el
virus. Muchas veces se hace notar que le VHS-1 causa infecciones en áreas por
encima de la cintura y el VHS-2 por debajo de la cintura pero esto refleja el
modo de transmisión más que alguna propiedad intrínseca del virus. Ambos tipos
de VHS pueden también infectar macrófagos y linfocitos de forma persistente. La
presencia del virus usualmente es demarcada por la formación de sincitios y
cuerpos de inclusión de Cowdry tipo A en los núcleos. Una vez que las células
epiteliales han sido infectadas, se da la replicación vírica alrededor de la
lesión y luego la entrada a la neurona innervante. El virus viaja a través de la
neurona (por un proceso de transporte retrógado) a los ganglios. En el caso de
las infecciones herpéticas de la mucosa oral, el virus viaja a los ganglios
trigeminales mientras que en las infecciones de la mucosa genital llevan al
virus a los ganglios sacrales. El virus también puede viajar en dirección
opuesta para llegar a la mucosa que inicialmente fue infectada. Las vesículas
que contienen el virus infeccioso se forman en la mucosa y el virus se disemina.
La vesícula se cura usualmente sin secuelas cicatriciales.
Respuesta inmune a los VHS 1 y 2
Como es de esperarse, ambas ramas de la respuesta inmune, la celular y la
humoral, son involucradas. El interferón es importante en la limitación de la
infección inicial y las células naturales asesinas (NK) también están implicadas
en esta fase. Las células T citotóxicas y los macrófagos forman las rama celular
de la respuesta y eliminan células infectadas. La rama humoral de la respuesta (generalmente
anticuerpos contra las glicoproteínas de superficie) lleva a la neutralización.
Como se dijo antes, el virus puede ‘escapar’ al sistema inmune al cubrirse con
IgG mediante receptores de Fc y receptores de complemento. El virus también
puede diseminarse de una célula a otra sin entrar al espacio extracelular en
donde contactaría anticuerpos humorales. Esto significa que la respuesta mediada
células es vital para el control de las infecciones por herpes. Las respuestas
mediada por células e inflamatoria conllevan a alguno de los síntomas de la
enfermedad.
|
| |
Latencia
Las partículas víricas pueden infectar neuronas y, puesto que sólo se
sintetizan proteínas tempranas inmediatas, no se da ningún efecto citopático
(aunque la presencia del virus puede ser detectada por técnicas tales como
la microscopía con inmunofluorescencia usando anticuerpos anti proteínas
inmediatas tempranas). El cese de la latencia puede ocurrir en estas células
y el virus puede viajar de vuelta por el axón nervioso. Entonces las
lesiones ocurren en el dermatoma, o sea la región cutánea inervada por un
único nervio espinal posterior. Esto significa que la recurrencia de
infección (y por ende de los síntomas) se da en el mismo sitio de la
infección inicial. Hay varios agentes que desencadenan una recurrencia, la
mayoría relacionados a estrés (tensión). También parece que la exposición
solar y quizás la fiebre pueden conllevar una recurrencia. Estos factores
pueden causar algún grado de supresión inmune que conlleve a la renovación
de la proliferación viral en la célula nerviosa. Las infecciones recurrentes
generalmente son menos pronunciadas que la infección primaria y se resuelven
más rápidamente.
|
|
Figura 8
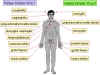 Localizaciones en las que los VHS-1 y VHS-2 causan enfermedades en humanos
Localizaciones en las que los VHS-1 y VHS-2 causan enfermedades en humanos
Figura 9
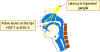 El virus herpes simplex puede desencadenar una infección primaria en los
labios, moverse al ganglio trigémino en donde puede permanecer latente.
El virus puede reactivarse, volver al sitio original de infección y
provocar herpes labial
El virus herpes simplex puede desencadenar una infección primaria en los
labios, moverse al ganglio trigémino en donde puede permanecer latente.
El virus puede reactivarse, volver al sitio original de infección y
provocar herpes labial |
Epidemiología
Las
infecciones por VHS 1 y 2 son vitalicias y aunque la latencia se establece con
rapidez, el paciente infectado puede infectar a otros como resultado de
recurrencia. El virus se encuentra en las lesiones cutáneas pero también puede
estar presente en diversos fluidos corporales incluyendo la saliva y secreciones
vaginales. A pesar de la aparente regla de arriba de la cintura/debajo de la
cintura, ambos tipos de VHS pueden infectar tanto la mucosa oral como la
genital dependiendo de las regiones de contacto (figura 8). No obstante, el
VHS-1 usualmente se transmite de boca a boca (al besar o al compartir utensilios
contaminados con saliva) o por la transferencia de virus infeccioso a las manos
y posterior penetración del mismo mediante heridas o por la mucosa de los ojos.
Una gran parte de la población muestra datos de infección por VHS-1 según
pruebas con anticuerpos. Como resultado de una pobre higiene en países en vías
de desarrollo, se encuentran anticuerpos al VSH-1 en más del 90% de la población
infantil.
El VHS-2
normalmente se disemina sexualmente y se encuentra en el ano, recto y tracto
alimentario superior así como en el área genital. Además, como se mencionó
anteriormente, un niño puede infectarse al nacer si la madre tiene infección
genital. El niño también puede adquirir la enfermedad in útero si la
infección de la madre se disemina. Debido a que el niño tiene un sistema inmune
poco desarrollado, la infección resultante puede ser muy severa y algunas veces
conllevar a la muerte.
Cualquiera que haga contacto con fluidos impregnados del virus infeccioso está
en riesgo. Existe una entidad que afecta a los profesionales de la salud
denominada panadizo herpético que resulta en lesiones en los dedos (puede ser
causado por cualquier tipo de VHS). Como es de suponer, las infecciones por
VHS-2 son más prevalentes más tarde en la vida, a medida que aumenta el número
de contactos sexuales. Por ende, las tasas más bajas de infección se encuentran
en niños las más altas en prostitutas, dentro de las cuales un 80% están
infectadas con VHS-2.
|
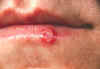 Lesión en el labio inferior de herpes simplex, segundo día luego del
comienzo de la infección.
CDC/Dr. Herrmann
Lesión en el labio inferior de herpes simplex, segundo día luego del
comienzo de la infección.
CDC/Dr. Herrmann
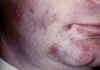 Virus Herpes simplex 1: Herpes labial
©
Archivo de Imágenes
de Bristol Biomedical. Usado con autorización
Virus Herpes simplex 1: Herpes labial
©
Archivo de Imágenes
de Bristol Biomedical. Usado con autorización
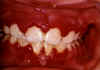
Gingivitis herpética
©
Archivo de Imágenes
de Bristol Biomedical. Usado con autorización
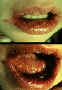 La gingivoestomatitis difiere del herpes labial, ocurre solo una vez y
con frecuencia es tan leve que pasa desapercibida.
©
Foro Australiano del
Manejo del Herpe
La gingivoestomatitis difiere del herpes labial, ocurre solo una vez y
con frecuencia es tan leve que pasa desapercibida.
©
Foro Australiano del
Manejo del Herpe
|
Enfermedades causadas por Virus Herpes Simplex
Los Herpes
simplex 1 y 2 son con frecuencia benignos pero también pueden causar
enfermedades severas. En cada caso, la lesión inicial es similar. Una vesícula
transparente, que contiene el virus infeccioso, con una lesión roja (eritematosa)
en la base de la vesícula. A esta usualmente se le refiere como ‘una gota de
rocío sobre el pétalo de una rosa’. De esta lesión purulenta (pústulas), pueden
desarrollarse lesiones encostradas y úlceras.
Herpes oral
– Grano de fiebre
Como se estableció previamente, este puede ser resultado de infecciones por
VHS-1 o VHS-2. Dada la asociación del VHS-2 con transmisión de índole sexual,
las infecciones en niños usualmente son causadas por el VHS-1. En la
gingivoestomatitis herpética primaria, se desarrollan primero las típicas
lesiones transparentes seguidas de úlceras que tienen una apariencia blanquecina.
La infección, de inicio frecuente en los labios se disemina a todas las partes
de la boca y faringe. La reactivación mediante los ganglios trigeminales puede
resultar en los llamados granos de fiebre. La faringitis herpética se asocia con
frecuencia a otras infecciones virales de tracto respiratorio superior. La
enfermedad es más severa en personas inmunosuprimidas tales como los pacientes
con SIDA (figura 9)
Queratitis herpética
Esta es una infección del ojo primariamente causada por el VHS-1. Puede ser
recurrente y conducir a ceguera. Es la principal causa de ceguera corneal en los
Estados Unidos
|
|
|
|
Figura 10
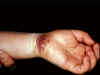 Panadizo herpético en la muñeca
©
Archivo de Imágenes de
Bristol Biomedical. Usado con autorización
Panadizo herpético en la muñeca
©
Archivo de Imágenes de
Bristol Biomedical. Usado con autorización
|
Panadizo herpético
Esta
enfermedad es de personas que han tenido contacto manual con secreciones
corporales infectadas con herpes y puede deberse a cualquier tipo de VHS.
Penetra al cuerpo mediante pequeñas heridas en las manos o muñecas. También
puede ser causada por transferencia del VHS-2 de los genitales a las manos (figura
10).
Herpes gladiatorum
Este es contraído por los luchadores. Aparentemente se transmite por
contacto directo con lesiones cutáneas de un luchador a su oponente, y
generalmente aparece en la región del cuello y cabeza (que son sitios
frecuentes de contacto en las posiciones de lucha). Extrañamente, las
lesiones son más frecuentes en el lado derecho del cuerpo (quizás porque en
muchos luchadores domina la mano derecha). También ocurre en otros deportes
de contacto como el rugby en donde se conoce como sífilis melé (Herpes
Rugbeiorum).
|
|
Figura 11
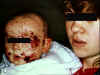 Madre con herpes labial sostiene bebé con eczema herpeticum
©
Archivo Imágenes de
Bristol Biomedical. Usado con autorización
Madre con herpes labial sostiene bebé con eczema herpeticum
©
Archivo Imágenes de
Bristol Biomedical. Usado con autorización
|
Eczema herpeticum
Este se encuentra en niños con eczema activo, dermatitis atópica
preexistente, y puede diseminarse en la piel en la región de las lesiones
eczematosas (figura 11). El virus puede diseminarse a otros órganos como el
hígado y las glándulas adrenales. Una enfermedad similar es causada por e
virus vaccinia (eczema vaccinatum).
|
|
|
Herpes
genital
El
herpes genital es usualmente resultado de VHS-2, mas cerca del 10% de los
casos resultan de VHS-1. La infección primaria es con frecuencia
asintomática pero muchas lesiones dolorosas pueden desarrollarse en el
glande o cuerpo del pene en los hombres y en la vulva, vagina, cerviz y
región perianal de las mujeres (figura 12). En ambos sexos, puede
involucrarse la uretra. En las mujeres, la infección puede acompañarse de
descargas transvaginales. Las infecciones genitales por herpes, que cursan
con una viremia transitoria, pueden acompañarse por una variedad de síntomas
incluyendo fiebre, mialgias, inflamaciones glandulares de la región inguinal
(adenitis
inguinal). Los episodios secundarios de herpes genital, ocurren como
resultado de una reactivación del virus en los ganglios sacros, y son
generalmente menos severas (y de menor duración) que el episodio debutante.
Los episodios recurrentes parecen causados de infecciones primarias por
VHS-2. Los pacientes que han de cursar con algún episodio recurrente primero
experimentan un prodromo en el cual sufren una sensación de quemazón en el
área en donde sobrevendrá la erupción. Algunos pacientes tienen apenas
recurrencias infrecuentes pero otros las experimentan tan a menudo como cada
14-21 días. Aún exista una enfermedad aparentemente activa o no, un
pacientes infectado permanece siendo contagioso sin síntomas manifiestos.
Claramente, estas personas son importantes en la diseminación de la
infección herpética.
Proctitis por VHS
Esta es
una inflamación del recto y del ano (figura 13).
Encefalitis por VHS
Esta es
generalmente causada por una infección por el VHS-1 y es la encefalitis
viral más comúnmente esporádica. La encefalitis por VHS es una enfermedad
febril y puede causar daño en los lóbulos temporales. Como consecuencia se
encuentra sangre en el líquido cefalorraquídeo y el paciente experimenta
síntomas neurológicos tales como las convulsiones. Esta entidad puede ser
fatal pero en los EUA se presentan menos de 1000 casos por año.
Meningitis por VHS
Causada
por infección por VHS-2. Los síntomas parecen remitir espontáneamente.
|
|
Figura 12
 Herpes genital en el pene
©
Foro Australiano del
Manejo del Herpes
Herpes genital en el pene
©
Foro Australiano del
Manejo del Herpes
 Herpes genital en el pene
©
Foro australiano del
Manejo del Herpes
Herpes genital en el pene
©
Foro australiano del
Manejo del Herpes
 Herpes
genital primario clásico afectando la vulva. Este cuadro clínico se
observa en una minoría de los casos
©
Foro Australiano del
Manejo del Herpes Herpes
genital primario clásico afectando la vulva. Este cuadro clínico se
observa en una minoría de los casos
©
Foro Australiano del
Manejo del Herpes
Figura 13
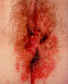 Herpes genital mal diagnosticado. Esta mujer también tenía una infección
estafilocócica secundaria.
©
Foro Australiano del
Manejo del Herpes
Herpes genital mal diagnosticado. Esta mujer también tenía una infección
estafilocócica secundaria.
©
Foro Australiano del
Manejo del Herpes
|
|
Figura 14
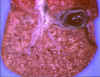 Infección hepática neonatal por herpes simplex ©
Archivo de Imágenes de Bristol Biomedical. Usado con autorización
Infección hepática neonatal por herpes simplex ©
Archivo de Imágenes de Bristol Biomedical. Usado con autorización
|
Infecciones por VHS en neonatos
Estas son causadas por VHS-2 y aunque raras, son generalmente fatales. La
infección es más probable si la madre está descamando el virus al momento
del parto. Por tanto, madres prospectivas han de evitar contraer herpes
durante el embarazo. Un primer episodio de infección por VHS-2 durante el
embarazo crea un mayor riesgo de transmisión al recién nacido. Si una mujer
tiene herpes genital activo al momento del parto, usualmente se realiza
parto por cesárea. El virus puede contraerse in útero o durante el
nacimiento, siendo esta última forma más frecuente. Dado que un neonato
tiene un sistema inmune subdesarrollado, el virus puede diseminarse
rápidamente a muchos órganos periféricos (i. e. hígado y pulmones) y pueden
infectar al sistema nervioso central (figura 14).
|
|
Figura 15
 Herpes simplex 1, Estudio de placa humana. Células cultivadas en células de
los simios chorlocebus africanos. Imagen de fase contrastada. ©
Archivo de Imágenes de Bristol Biomedical. Usado con autorización
Herpes simplex 1, Estudio de placa humana. Células cultivadas en células de
los simios chorlocebus africanos. Imagen de fase contrastada. ©
Archivo de Imágenes de Bristol Biomedical. Usado con autorización
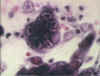 Herpes simplex 1: Tinción histológica. Note la célula multinucleada con
inclusiones teñidas de oscuro. ©
Archivo de Imágenes
de Bristol Biomedical. Usado con autorización
Herpes simplex 1: Tinción histológica. Note la célula multinucleada con
inclusiones teñidas de oscuro. ©
Archivo de Imágenes
de Bristol Biomedical. Usado con autorización
|
Diagnóstico de Infecciones por VHS
Se pueden
obtener células de la base de la lesión (para un frotis Tzank) y realizar
histoquímica. Puesto que una característica del herpesvirus es la fijación a pH
neutro, las células infectadas pueden fundirse creando sincitios. Estos pueden
observarse en los extendidos como células gigantes multinucleadas y contiene
cuerpos de inclusión de Cowdry tipo A (figura 15). Estas células también pueden
verse con tinción de anticuerpos específicos en un ensayo de inmunofluorescencia
y también es posible detectar el ADN viral por hibridación in situ. Se
pueden distinguir entre anticuerpos tipo-específicos de los VHS-1 y VHS-2.
El virus
puede aislarse de especimenes biopsiados, esto es de la misma lesión, y
cultivarse en cultivos celulares en donde causa efectos citopáticos
característicos (placas) incluyendo células multinucleadas (figura 15). La
presencia de anticuerpos anti-VHS en el paciente puede utilizarse para dar el
diagnóstico de infección primaria pero un episodio recurrente generalmente no se
acompaña de un aumento en los niveles de anticuerpos.
Quimioterapia para el VHS
Hay una
variedad de fármacos análogos de nucleósidos para tratar las infecciones por
herpes, muchos de los cuales son de alta especificidad puesto que toman ventaja
del hecho de que el fármaco es activado por una enzima vírica, la timidina
cinasa (refiérase a la sección de quimioterapia). El hecho de que el fármaco
sólo se activa en células infectadas por herpes (porque sólo aquí se encuentra
expresada la timidina cinasa específica) significa que este fármaco da muy pocos
efectos secundarios.
El más
conocido de los análogos nucleósidos es la acicloguanosina (aciclovir) pero hay
otras drogas aprobadas incluyendo famciclovir y valaciclovir. Todos estos
análogos de nucleósidos muestran la aparición de herpes mutantes resistentes
aunque las cepas resistentes del virus son generalmente menos virulentas que las
cepas silvestres. Nótese que estos fármacos actúan contra el virus en
replicación (son incorporados al ADN mientras se copia) y por ello son
inefectivos contra el virus latente.
Dado que
una vez infectado, el paciente alberga el virus de por vida, la mejor opción es
prevenir la infección evitando el contacto con el virus. Esto es de particular
importancia para profesionales de la salud. No obstante, esto no siempre es
posible, porque muchos pacientes con replicación viral activa son asintomáticos.
Los pacientes con herpes genital deben de evitar relaciones sexuales cuando
tienen síntomas prodrómicos pruriginosos o la lesión activa.
|
|
FUENTES EN LA RED
(en inglés)
CDC varicela y
culebrilla |
Virus Varicela-Zoster (también llamado Virus Herpes Zoster, Herpesvirus
Humano-3)
(figura 16)
Zoster
significa “faja” por el sarpullido característico que forma un cinturón
alrededor del tórax en muchos pacientes (figura 18). La estructura del virus de
la Varicela es muy similar a la del Herpes Simplex aunque el genoma es algo más
pequeño.
Enfermedades causadas por el virus Varicela-Zoster
Este virus
causa dos enfermedades principales, varicela (peste cristal), generalmente en la
niñez, y herpes zoster (culebrilla), más tarde en la adultez. La culebrilla
(zoster) es una reactivación de una infección previa de varicela.
Varicela (Peste cristal)
Este virus
es altamente infeccioso (figura 19) y aún si no recordamos haberlo tenido, más
del 90% de la población de los EUA tiene anticuerpos contra las proteínas de la
varicela. En la casa de un paciente infectado, 90% de los contactos que hasta el
momento no hayan tenido la enfermedad, la contraerán (a menos que estén
vacunados). Se contagia por aerosoles respiratorios o contacto directo con
lesiones cutáneas. Al igual que con el VHS, la infección es vía la mucosa, pero
en este caso, por la mucosa del tracto respiratorio.
Durante la
fase prodrómica de 10-13 días, el virus se encuentra en la mucosa respiratoria e
infecta macrófagos y neumocitos. En esta fase, no hay síntomas. El virus se
disemina de los pulmones a los linfocitos y monolitos y al sistema
retículo-endotelial. En este lugar, a los 5 días aproximadamente, ocurre una
segunda viremia y el virus viaja a la piel, boca, conjuntiva, tracto
respiratorio y, de hecho, a las localizaciones epiteliales en todo el cuerpo.
Aquí el virus abandona los vasos sanguíneos y primero infecta localizaciones
subepiteliales y luego epiteliales formando pápulas que contiene células
multinucleadas con inclusiones intracelulares. El virus alcanza la superficie y
es descamado al exterior del tracto respiratorio 12-14 días después de la
infección inicial. Le toma un poco más de tiempo al virus (unos cuantos días)
alcanzar la superficie de la piel en donde se manifiestan las pápulas
(dermatitis) características. En esta etapa el paciente probablemente cursará
con fiebre de varios días (hasta 39 grados centígrados). Se dan varias etapas
entre la infección inicial y la ocurrencia de pápulas que son diagnósticas de
varicela pero el promedio es de dos semanas con un rango entre 10 y 23 días (figura
17). La diseminación de la enfermedad puede ser del virus en el tracto
respiratorio (mediante la tos) o por contacto con pápulas que contienen el virus
infeccioso, reventadas en la piel. Por ende el periodo contagioso es
aproximadamente 12-14 días después de la infección inicial.
Por alguna
razón, la dermatitis es más pronunciada en la cara, cuero cabelludo y tronco, y
lo es menos en las extremidades. La enfermedad es más severa en niños mayores y
en adultos. Este es particularmente el caso con pacientes inmunocomprometidos (SIDA,
transplantes, etc.) en quienes la enfermedad puede persistir varias semanas y la
fiebre puede ser más pronunciada. La diseminación del virus puede conllevar
problemas pulmonares, hepáticos, y meningitis. En este caso la mortalidad puede
aumentar a 20%.
Complicaciones
La neumonía
puede asociarse con infección por varicela (cerca del 15% de los pacientes
adultos) y puede ser fatal.
Aunque la
mayoría de los niños recurre rápidamente la enfermedad, existen algunas
complicaciones. Estas incluyen encefalitis fulminante y ataxia cerebelar. Es
posible que alguna de estas complicaciones sea el Síndrome de Reye. Se ha
hipotetizado que este último es causado por el uso de aspirina en infecciones de
varicela. Otras complicaciones raras de la varicela son la mielitis transversa,
síndrome de Guillian – Barre y meningitis aséptica.
Síndrome de Varicela Congénito
Las
infecciones in útero en el primer trimestre pueden causar serios
problemas. Este es el caso del síndrome de varicela congénita que implica
escaras en las extremidades, daño al lente ocular, la retina, y el cerebro y
microftalmia.
La infección de la madre, quien presumiblemente no ha sido previamente infectada
y por tanto no posee anticuerpos anti-varicela, en un periodo cercano al parto
puede conllevar una infección del infante. Puesto que el infante no tendrá
anticuerpos maternos contra la varicela y tiene una inmunidad celular todavía
inmadura, puede sucumbir a la enfermedad con una tasa de mortalidad de hasta
35%. Si la madre se infecta cerca del término del embarazo, ambos ella (antes
del parto) y su bebé (inmediatamente luego del parto) han de ser tratados con
inmunoglobulina de varicela. La mayoría de los niños, no obstante, obtienen
anticuerpos maternos transplacentariamente y están protegidos de la enfermedad.
|
|
Figura 16
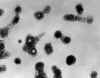 Micrografía de transmisión de electrones de viriones de varicela- zoster de
líquido de una vesícula de una paciente con varicela. CDC/Dr. Erskine
Palmer
Micrografía de transmisión de electrones de viriones de varicela- zoster de
líquido de una vesícula de una paciente con varicela. CDC/Dr. Erskine
Palmer
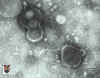 Tinción negativa del virus varicela zoster
© Dr. S. McNulty, Universidad de Queens, Belfast. Esta imagen no puede
usarse para fines comerciales sin el consentimiento de los poseedores
del derecho reservado.
Tinción negativa del virus varicela zoster
© Dr. S. McNulty, Universidad de Queens, Belfast. Esta imagen no puede
usarse para fines comerciales sin el consentimiento de los poseedores
del derecho reservado.
Figura 17
 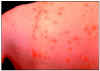
Esta persona tiene una dermatitis de varicela. Algunas de las lesiones
son máculas eritematosas y otras son vesículas. Las manchas rojas se
volverán ampollas y nuevas manchas rojas sobrevendrán CDC
 Cada mácula comienza resulta en una pápula roja de 2-4 mm de diámetro
que desarrolla un contorno irregular (pétalo de rosa) a medida que
aparece una pequeña vesícula en la superficie. Esta apariencia de “gota
de rocío en el pétalo de una rosa” es muy característica de la varicela.
©
Foro Australiano de
Manejo del Herpes
Cada mácula comienza resulta en una pápula roja de 2-4 mm de diámetro
que desarrolla un contorno irregular (pétalo de rosa) a medida que
aparece una pequeña vesícula en la superficie. Esta apariencia de “gota
de rocío en el pétalo de una rosa” es muy característica de la varicela.
©
Foro Australiano de
Manejo del Herpes
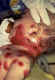 Este es un caso clásico de varicela en un recién nacido. El infante
contrajo varicela al nacer de la madre infectada. Una infección cutánea
severa se desarrolló en la cara y cuello y, sin tratamiento, esta
infección podría diseminarse por todo el cuerpo y causar una enfermedad
seria o incluso la muerte
Cortesía de la Academia Americana de Pediatría, División de Pennsylvania
– Coalición de Acción de Inmunización
Este es un caso clásico de varicela en un recién nacido. El infante
contrajo varicela al nacer de la madre infectada. Una infección cutánea
severa se desarrolló en la cara y cuello y, sin tratamiento, esta
infección podría diseminarse por todo el cuerpo y causar una enfermedad
seria o incluso la muerte
Cortesía de la Academia Americana de Pediatría, División de Pennsylvania
– Coalición de Acción de Inmunización
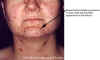
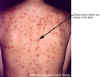 Femenina de 30 años de edad con varicela. Hay una dermatitis generalizada sobre
toda la espalda.
Femenina de 30 años de edad con varicela. Hay una dermatitis generalizada sobre
toda la espalda.
Imágenes © Lewis Tomalty, Universidad de Queens, Kingston,
Ontario K7L 3N6 Canada y The MicrobeLibrary
|
| |
|
|
|
Culebrilla
Luego
del periodo infeccioso, el virus puede migrar a los ganglios asociados con
áreas en las que el virus se replica activamente. El virus puede entonces
ser reactivado bajo situaciones de tensión (estrés) o de supresión del
sistema inmune. Esto usualmente ocurre en etapas avanzadas de la vida. La
recurrencia de la replicación de la varicela se acompaña de dolor radicular
severo (figura 18) en áreas discretas, aquellas inervadas por el nervio en
el que la infección latente ha ocurrido. Unos días más tarde lesiones
similares a la de la varicela (figura 18) suceden en áreas restringidas (dermatoma)
que son inervadas por un único ganglio. Nuevas lesiones aparecen en
dermatomas adyacentes y alejadas. La reactivación puede afectar el ojo vía
el nervio trigémino (uveítis, queratitis, conjuntivitis, oftalmoplegía,
iritis) y el cerebro mediante los nervios craneales VII y VIII (Parálisis de
Bell y Síndrome de Ramsay-Hunt (figura 18)). Las lesiones cutáneas son un
tanto diferente a las de la varicela, estando restringidas a pequeñas áreas
de piel, usualmente en el tórax (figura 18). Son pequeñas y cercanas unas
con otras. Son maculopapulares con una base eritematosa y usualmente se
resuelven en más o menos 2 semanas. La reactivación puede llevar a sensación
crónica de quemazón o a un dolor pruriginoso llamado neuralgia post-herpética,
la cual se observa principalmente en pacientes mayores de edad. El dolor
puede perdurar luego de que la dermatitis haya curado (meses o años). Con
frecuencia se asocia una sensibilidad aumentada al tacto (hiperestesia o
causalgia) con la neuralgia post-herpética.
Los
pacientes son SIDA con frecuencia manifiestan recurrencias multi-dermatomales
de infección por varicela. En algunos pacientes con SIDA también se da una
forma crónica verrucosa.
|
|
Figura 18
 Sarpullido aislado típico en herpes zoster o culebrilla
CDC
Sarpullido aislado típico en herpes zoster o culebrilla
CDC
 En los casos severos de zoster, las lesiones coalescen, formando una capa de
costras y algunas veces deja cicatrices permanentes
© Foro Australiano de Manejo del Herpes
En los casos severos de zoster, las lesiones coalescen, formando una capa de
costras y algunas veces deja cicatrices permanentes
© Foro Australiano de Manejo del Herpes
|
 Culebrina afectando el lado izquierdo del torso ©
Foro Australiano de
Manejo del Herpes
Culebrina afectando el lado izquierdo del torso ©
Foro Australiano de
Manejo del Herpes
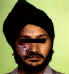
 Varicela zoster recurrente en el lado derecho de la cara
© Archivo de Imágenes de Bristol Biomedical
Varicela zoster recurrente en el lado derecho de la cara
© Archivo de Imágenes de Bristol Biomedical
 Episodio severo atípico de culebrilla afectando el torso de una persona con
inmunidad deficiente. Note que la distribución de las lesiones asemeja “la
correa de una espada”. Por ello el nombre zoster
© Foro Australiano de Manejo del Herpes
Episodio severo atípico de culebrilla afectando el torso de una persona con
inmunidad deficiente. Note que la distribución de las lesiones asemeja “la
correa de una espada”. Por ello el nombre zoster
© Foro Australiano de Manejo del Herpes
|
 Lesiones diseminadas afectando múltiples dermatomas
©
Foro Australiano de
Manejo del Herpes
Lesiones diseminadas afectando múltiples dermatomas
©
Foro Australiano de
Manejo del Herpes |
 Culebrilla facial. El dermatoma involucrado es el de la división oftálmica
del nervio trigémino.
© Foro Australiano de Manejo del Herpes
Culebrilla facial. El dermatoma involucrado es el de la división oftálmica
del nervio trigémino.
© Foro Australiano de Manejo del Herpes
 Zoster
afectando el dermatoma L1 derecho
©
Foro Australiano de
Manejo del Herpes
Zoster
afectando el dermatoma L1 derecho
©
Foro Australiano de
Manejo del Herpes
|
 Síndrome de Ramsay-Hunt afectando la oreja manifestando formación de bulas
en el canal auricular externo
©
Foro Australiano de
Manejo del Herpes
Síndrome de Ramsay-Hunt afectando la oreja manifestando formación de bulas
en el canal auricular externo
©
Foro Australiano de
Manejo del Herpes |
 Síndrome de Ramsay-Hunt causando una parálisis facial derecha. La parálisis
es más obvia en los casos de culebrilla que comprometen la cara. Está
causada por una extensión del proceso patológico a las regiones motoras del
cordón espinal o del tallo cerebral. En la minoría de los casos, las áreas
de parálisis y dermatosis no coinciden. Por ejemplo, dermatosis en el cuello
y en la parte inferior de la cara, involucrando los nervios trigémino y
cervical, puede asociarse con parálisis del nervio facial y pérdida de la
sensación del gusto. Esta distribución del rash y combinación de síntomas
sensoriales y motores no puede ser explicada por el daño de un único ganglio
nervioso o un tronco nervioso mixto sensorial y motor. En vez, ha de ser
resultado de una diseminación mayor, si todavía es local, del virus en el
sistema nervioso central.
©
Foro Australiano de
Manejo del Herpes
Síndrome de Ramsay-Hunt causando una parálisis facial derecha. La parálisis
es más obvia en los casos de culebrilla que comprometen la cara. Está
causada por una extensión del proceso patológico a las regiones motoras del
cordón espinal o del tallo cerebral. En la minoría de los casos, las áreas
de parálisis y dermatosis no coinciden. Por ejemplo, dermatosis en el cuello
y en la parte inferior de la cara, involucrando los nervios trigémino y
cervical, puede asociarse con parálisis del nervio facial y pérdida de la
sensación del gusto. Esta distribución del rash y combinación de síntomas
sensoriales y motores no puede ser explicada por el daño de un único ganglio
nervioso o un tronco nervioso mixto sensorial y motor. En vez, ha de ser
resultado de una diseminación mayor, si todavía es local, del virus en el
sistema nervioso central.
©
Foro Australiano de
Manejo del Herpes
|
 La más común y más temible de las complicaciones del zoster es la
persistencia de dolor en el área corporal afectada luego de que el rash ha
cedido. Esto se conoce comúnmente como neuralgia post-herpética, la cual
puede ser severa y prolongada, particularmente en pacientes de mayor edad.
Desafortunadamente puede ser muy resistente a tratamiento, pero mediante el
tratamiento del zoster con un agente antiviral antes de 3 días luego de la
aparición del rash, es posible reducir la posibilidad de dolor prolongado o
por lo menos de reducir la duración total del dolor.
© Foro Australiano de Manejo del Herpes
La más común y más temible de las complicaciones del zoster es la
persistencia de dolor en el área corporal afectada luego de que el rash ha
cedido. Esto se conoce comúnmente como neuralgia post-herpética, la cual
puede ser severa y prolongada, particularmente en pacientes de mayor edad.
Desafortunadamente puede ser muy resistente a tratamiento, pero mediante el
tratamiento del zoster con un agente antiviral antes de 3 días luego de la
aparición del rash, es posible reducir la posibilidad de dolor prolongado o
por lo menos de reducir la duración total del dolor.
© Foro Australiano de Manejo del Herpes
Figura
19
 Casos de Varicela por estado, Estados Unidos, 1972-1996.
CDC/Bárbara Rice
Casos de Varicela por estado, Estados Unidos, 1972-1996.
CDC/Bárbara Rice
|
Diagnóstico
Tanto la
varicela como la culebrina son diagnosticadas por su apariencia característica
pero un diagnóstico definitivo puede realizarse por cultivo del virus de las
lesiones (un procedimiento difícil) seguido de detección de antígenos. La
apariencia característica de las células en los especimenes biopsiados de las
lesiones cutáneas también puede usarse para diagnóstico.
Tratamiento
Al igual
que con el VHS, el aciclovir (u otros análogos nucleósidos) pueden ser útiles,
en particular en la prevención de la diseminación en los pacientes
inmunosuprimidos. La inmunoglobulina de la varicela también puede usarse.
Normalmente, no obstante, solo se usa tratamiento sintomático en los niños, que
se recuperan rápidamente si tienen una adecuada respuesta inmune mediada por
células.
Vacuna
Hay una
vacuna de virus vivo atenuado y se usa en los Estados Unidos. Conlleva la
producción de anticuerpos y de inmunidad mediada por células. Puede
administrarse post-exposición.
Virus Epstein
- Barr
El virus de
Epstein-Barr es el agente causal del linfoma de Burkitt en África, carcinoma
nasofaríngeo en el Oriente, y de mononucleosis infecciosa en el Oeste. Fue
originalmente descubierto como en agente causal del linfoma de Burkitt y luego
se descubrió que los pacientes con mononucleosis infecciosa tienen anticuerpos
que reaccionan con células del linfoma de Burkitt.
Receptores
del virus
El virus
sólo infecta un pequeño número de tipos celulares que expresan el receptor para
el componente C3d del complemento (CR2 o CD21). Estas son ciertas células
epiteliales (oro- y naso-faringe) y linfocitos B. Esto explica el tropismo
celular del virus.
Replicación
semi-permisiva
Los
linfocitos B solo son semi-permisivos para la replicación del virus y la
infección puede o ser latente o las células pueden ser estimuladas y
transformadas por el virus. Cuando los linfocitos son infectados latentemente
las células contienen unas cuantas copias no integradas (episomas) del genoma
viral que son replicadas cada vez que la célula se divide. En este caso los
genes de fase temprana inmediata son expresados incluyendo los antígenos
nucleares del VEB. Además se expresan dos proteínas de membrana latentes, un
proteína designada LP (proteína de unión al ADN) y dos pequeñas moléculas de ARN.
Las proteínas de membrana son oncogenes.
Replicación
permisiva
En
contraste, las células epiteliales permiten la replicación lítica completa del
virus. Las células epiteliales permiten la expresión de la proteína ZEBRA que
activa genes de fase temprana resultando en la expresión de la polimerasa y la
replicación del ADN. Subsiguientemente, se sintetizan las proteínas de la
cápside y las glicoproteínas de membrana.
Patogénesis
Transformación de células B
El virus se replica en las células epiteliales faríngeas, descamado a la salida
e integrado por linfocitos B CD21+. Estas células son normalmente de corta vida,
muriendo por apoptosis. Este es un proceso natural que permite a las células ser
generadas para un proceso particular y luego removidas cuando ya no son
necesarias. Aunque las células B no muestran ninguna alteración histológica por
la infección por el VEB, son estimuladas para dividirse y para no experimentar
apoptosis; por tanto, la célula se transforma y unos altos niveles de monocitos
se detectan en sangre. La transformación de la célula B cambia la interacción de
la célula con otros componentes del sistema inmune. Los marcadores HLA (antígeno
leucocitario humano), el antígeno CD23 y ciertas proteínas de adhesión también
son expresados. La presencia de los virus resulta en la expresión de un análogo
de la interleucina-10 (IL-10) que inhibe la secreción de gamma interferón. Lo
cual resulta en la inhibición de la respuesta de las células T y promueve el
crecimiento de las células B y la secreción de IgG. El virus también causa que
las células produzcan otras citoquinas incluyendo IL-5 y IL-6.
Linfoma
de Burkitt
La asociación del virus de Epstein-Barr virus con el linfoma de Burkitt fue
establecida hace mucho tiempo. Este es un tumor de la mandíbula y cara
encontrado en niños (figura 20). Las células tumorales evidencian ADN del VEB y
antígenos tumorales y el paciente manifiesta unos niveles de anticuerpos anti-VEB
muchos más altos que otros miembros de la población. Las células tumorales son
monoclonales y muestran una translocación muy característica entre los
cromosomas 8 y 14. esto coloca al c-myc cerca del gen de la cadena pesada de
inmunoglobulina. En consecuencia, el oncogen está próximo al promotor de un gen
que es altamente expresado en los linfocitos B resultando en una elevada
transcripción del c-myc. Ha de notarse que esta translocación no se ve en
pacientes con mononucleosis infecciosa. Las biopsias tisulares muestran células
multinucleadas grandes (figura 21). Hay más evidencias que implican al VEB con
en linfoma de Burkitt como la observación de que el VEB puede transformar
linfocitos B en cultivos y puede producir linfomas de células B en algunos
primates.
Este linfoma es endémico en el África ecuatorial pero rara vez ocurre en alguna
otra parte. El porqué de esto no está clarificado pero quizás exista alguna
razón genética probablemente asociada a la malaria. Las personas resistentes a
la malaria parecen ser susceptibles a la progresión del linfoma.
|
|
Figura 20
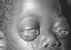 Linfoma de Burkitt
Archivo de Imágenes de The Johns Hopkins Autopsy Resource (JHAR)
Linfoma de Burkitt
Archivo de Imágenes de The Johns Hopkins Autopsy Resource (JHAR)
Figure 21
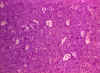 Tinción histológica de linfoma de Burkitt. Note las células grandes
multinucleadas
Tinción histológica de linfoma de Burkitt. Note las células grandes
multinucleadas
© Archivo de Imágenes de Bristol Biomedical. Usado con autorización
|
|
Figura 22
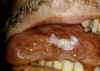 Leucoplaquia vellosa oral de la lengua en SIDA
©
Archivo de Imágenes de
Bristol Biomedical
Leucoplaquia vellosa oral de la lengua en SIDA
©
Archivo de Imágenes de
Bristol Biomedical
|
Cáncer nasofaríngeo
Esta
patología, que ocurre en un determinado número de áreas (el sur de China,
Alaska, Tunisia, y el este de África), también se asocia con el VEB. Podría
haber una predisposición genética para el desarrollo de neoplasias de VEB en
estas poblaciones o podría haber algún cofactor ambiental involucrado
también. La patología es un tumor del epitelio del tracto respiratorio
superior y las células contienen ADN de VEB. Las titulaciones de anticuerpos
anti-VEB se alteran a medida que progresa el tumor.
Leucoplaquia vellosa/pilosa oral
Esta enfermedad VEB-asociada resulta en lesiones en la boca y ha aumentado
su incidencia recientemente dado que es una infección oportunista en
pacientes infectados con VIH (figura 22).
|
|
|
Mononucleosis Infecciosa
La infección primaria es con frecuencia asintomática pero el paciente puede
desacatar el virus infeccioso por muchos años. Algunos pacientes desarrollan
mononucleosis infecciosa luego de 1- meses de infección. La enfermedad se
caracteriza por malestar general, linfadenopatía, tonsilitis (figura 23),
hepatoesplenomegalia y fiebre. La fiebre puede persistir por más de una
semana. También puede suceder un rash. La severidad de la enfermedad
usualmente depende de la edad del paciente (siendo los más jóvenes quienes
se recuperan más rápidamente) y la resolución se da generalmente entre 1 y 4
semanas.
Aunque
la mononucleosis infecciosa es generalmente benigna, puede haber
complicaciones. Estas incluyen desórdenes neurológicos tales como
meningitis, encefalitis, mielitis y síndrome de Guillain-Barrè. También
puede verse infecciones secundarias, anemia hemolítica autoinmune,
trombocitopenia,
agranulocitosis, anemia aplásica. Como se mencionó antes también puede darse
un síndrome crónico. Los síntomas son similares a aquellos reportaros por el
síndrome de fatiga crónica (cefaleas, dolor de garganta y fiebre leve)
aunque es improbable que el VEB sea la causa del síndrome de fatiga crónica.
|
|
Figura 23
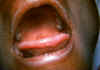 Lengua y paladar de un pacientes con mononucleosis infecciosa.
CDC/Emory U./Dr. Sellers
Lengua y paladar de un pacientes con mononucleosis infecciosa.
CDC/Emory U./Dr. Sellers
|
En la
mononucleosis infecciosa, las células B infectadas también sufren transformación.
Las células B infectadas proliferan y activan el supresor de las células T CD8.
Estas células T difieren de células T normales en apariencia y son llamadas
células de Downey. Las células T aumentan en número en la circulación y pueden
representar hasta el 80% de los glóbulos blancos sanguíneos. Esta respuesta de
las células T resulta en linfadenomegalia (y en hepatoesplenomegalia). La
activación de las células T limita la proliferación de las células B y la
enfermedad se resuelve.
Si la inmunidad celular es reprimida, no ocurre la resolución de la enfermedad.
La replicación viral descontrolada puede conllevar un severo síndrome con
linfoproliferación de células B, leucopenia y linfoma. En pacientes con
deficiencia de células T también puede ocurrir desorden linfoproliferativo
ligado al X. Los pacientes transplantados y los pacientes con SIDA quienes están
inmunosuprimidos pueden presentar un desorden linfoproliferativo post-transplante.
|
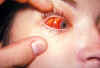
Hemorragia conjuntival del ojo derecho en un pacientes con mononucleosis
infecciosa. A veces, pueden manifestarse una conjuntivitis no infecciosa,
así como anormalidades corneales por la respuesta sistémica a infecciones
virales como la mononucleosis infecciosa o virus Epstein-Barr.
CDC/Dr. Thomas F. Sellers/Universidad de Emory
 Células de leucemia que contienen el virus Epstein Barr usando una
técnica de tinción fast-acid
CDC/Dr. Paul M. Feorino
Células de leucemia que contienen el virus Epstein Barr usando una
técnica de tinción fast-acid
CDC/Dr. Paul M. Feorino
|
Epidemiología
Una gran
proporción de la población (90-95%) está infectada con el virus de Epstein-Barr
y estas personas, aunque generalmente están asintomáticas, descaman el virus de
vez en cuando a lo largo de sus vidas. El virus se contagia por contacto cercano
(enfermedad del beso). La infección se asocia a factores socioeconómicos y en
países en desarrollo, la seropositividad se detecta a edades más tempranas que
en países desarrollados. Cerca del 80% de los estudiantes de Estados Unidos, al
entrar a la preparatoria son seropositivos para el virus y muchos de aquellos
que son negativos se convertirán en positivos durante sus estudios
universitarios. El virus también puede diseminarse por transfusión sanguínea.
Diagnóstico
En la
mononucleosis infecciosa, los extendidos de sangre periférica muestran
linfocitos atípicos (células de Downey). También hay exámenes serológicos
disponibles. Los anticuerpos heterófilos se producen por células B
proliferativas y estos incluyen una IgM que interactúa con el antígeno de Paul-Bunnell
en células sanguíneas ovinas.
Tratamiento
A
diferencia del virus herpes simplex, no hay fármacos disponibles para tratar el
virus de Epstein-Barr. Esto puede reflejar la ausencia de una timidina cinasa
codificada por este virus (fármacos como el aciclovir, que son activos contra el
herpes simplex, son activados por la timidina cinasa viral). Hay una vacuna en
desarrollo.
|
|
|
Citomegalovirus
El
citomegalovirus tiene el genoma más grande de todos los herpesvirus y parece
que solo se replica en células humanas. Su nombre deriva del hecho de que,
como otros herpesvirus, puede formar células multinucleadas (sincitios) con
inclusiones características a la tinción. Algunas células como los
macrófagos y fibroblastos sufren una infección productiva mientras que en
otros tipos de células se establece una infección latente, entre esas
últimas se incluyen los linfocitos T y las células estromales de la médula
ósea. Solo hay un serotipo.
Transmisión
La infección por citomegalovirus se encuentra en una proporción
significativa de la población. Al igual que como sucede con el virus de
Epstein-Barr virus (también contagiado por saliva), la seropositividad
aumenta con la edad. Para la edad universitaria, el 15% de la población de
EU están infectada y esto aumenta a cerca de la mitad para la edad de 35
años. El virus se disemina en muchas secreciones, particularmente saliva,
orina, secreciones vaginales y semen (en donde se encuentran las
titulaciones más altas que en ningún otro fluido corporal). Por tanto la
infección por citomegalovirus es de transmisión sexual. Puede transmitirse
al feto en mujeres embarazadas y al neonato mediante lactancia, aunque hay
dudas acerca de la trasmisión por lactancia. En el hospital, el virus
también puede diseminarse por transfusiones sanguíneas y transplantes. En
países del tercer mundo con condiciones de hacinamiento, el virus se
encuentra en una mayor proporción de la población que en países occidentales.
Patogénesis
El citomegalovirus con causa síntomas en los niños y como mucho alguna
enfermedad leve en los adultos (pero vea más adelante). El virus primero
infecta el tracto respiratorio superior y luego los linfocitos locales. Los
linfocitos circulantes transmiten el virus a otros linfocitos y monolitos en
el bazo y el nódulos linfáticos. Finalmente el virus se disemina a una
variedad de células epiteliales incluyendo aquellas de las glándulas
salivares, túbulos renales, testículos, epidídimo y cerviz. La infección
usualmente es asintomática (subclínica) pero a veces se manifiesta como
fiebre glandular en los adultos jóvenes. El virus puede inhibir la respuesta
de las células T. El virus implica tanto una respuesta de anticuerpos
humorales así como inmunidad celular pero la infección no es resuelta. La
inmunidad celular, no así los anticuerpos humorales, controlan la infección.
La importancia de la inmunidad celular surge de la posibilidad de
transmisión de célula a célula. Aunque reprimido, el virus puede reactivarse
después, particularmente en casos de inmunosupresión; de hecho, la infección
por el virus puede, por sí misma, ser inmunosupresiva.
|
| |
| Figura 24
A
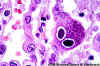 Una tinción de H-E de una sección pulmonar mostrando inclusiones nucleares
con la apariencia de “ojos de búho”. La inclusión está rodeada por un hablo
blanquecino que se extiende a la membrana nuclear. La infección por CMV
puede ocurrir sin las típicas células citomegálicas
Una tinción de H-E de una sección pulmonar mostrando inclusiones nucleares
con la apariencia de “ojos de búho”. La inclusión está rodeada por un hablo
blanquecino que se extiende a la membrana nuclear. La infección por CMV
puede ocurrir sin las típicas células citomegálicas
B
Tinción con H-E de células infectadas con CMV en tejido pulmonar de paciente
con SIDA. Pueden verse inclusiones nucleares
Ambas imágenes © Danny L. Wiedbrauk, Hospital William Beaumont en Royal
Oak, Michigan y Joan E.Barenfanger
Centro Médico Memorial Springfield, Illinois y
The MicrobeLibrary
Figura 24a
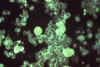 Espécimen de pulmón embrionario revela la presencia de citomegalovirus
con técnicas de inmunofluorescencia.
Mag. 25X. CDC/Dr. Craig Lyerla
Espécimen de pulmón embrionario revela la presencia de citomegalovirus
con técnicas de inmunofluorescencia.
Mag. 25X. CDC/Dr. Craig Lyerla
|
Enfermedad
congénita
Hay dos maneras mediante las que el citomegalovirus puede causar una enfermedad
seria. Durante una infección primaria de la madre, el virus puede diseminarse
mediante la placenta al feto y causar anormalidades congénitas. Casi uno de cada
cuarenta neonatos en los Estados Unidos está infectados por el virus. Las
anormalidades incluyen microcefalia, rash, calcificaciones cerebrales y
hepatoesplenomegalia. Estas pueden resultar en sordera (bilateral o unilateral)
y retraso mental. Como es de esperarse, cuando ocurre la reactivación en una
mujer embarazada (con frecuencia se da en el cerviz), los síntomas son menos
severos dada la seropositividad de la madre. En este caso, las anomalías
congénitas son raras.
Aparte de
la infección in útero, los niños pueden infectarse perinatalmente. Como
se mencionó anteriormente, un tejido en el que el citomegalovirus puede crear
una infección latente es en el epitelio cervical y la inmunosupresión asociada
el embarazo implica una reactivación. Cerca del 50% de los niños nacidos de
tales madres están infectados y pueden también descamar el virus en pocas
semanas. También el epitelio mamario puede albergar el virus latente que puede
ser activado similarmente conllevando a la infección del niño. En ningún caso
hay problema y el bebé permanece asintomático.
Los
neonatos también pueden adquirir el virus a través de transfusiones sanguíneas
infectadas. En este caso, la cantidad de virus es mucho mayor y sí pueden
presentarse síntomas. Estos generalmente consisten en neumonía y hepatitis.
Patología
en pacientes inmunosuprimidos
En pacientes que han recibido un transplante de órganos o tienen una enfermedad
inmunosupresiva (i.e. SIDA), el citomegalovirus puede ser un problema serio.
Particularmente importante es la retinitis por citomegalovirus que ocurre en
casi 15% de todos los pacientes con SIDA. Además de, neumonía intersticial,
colitis, esofagitis y encefalitis.
Diagnóstico
La mayoría de las infecciones son asintomáticas y por tanto pasan sin
diagnosticar. Hay anticuerpos fluorescentes (Fig. 24a) y exámenes de ELISA.
También en muchas biopsias titulares pueden detectarse células multinucleadas (citomegálicas)
con inclusiones características (Figura 24).
Tratamiento
Ganciclovir, que inhibe la replicación de todos los herpesvirus humanos, es
generalmente usado, especialmente para tratar la retinitis. El Foscarnet está
también aprobado en los EU. EL aciclovir no es efectivo. Una vacuna está siendo
desarrollada pero la mejor manera de evitar el virus es restringir el contacto
entre niños infectados y mujeres embarazadas. También, como el citomegalovirus
tiene transmisión sexual, el uso de preservativos (condones) puede limitar su
diseminación.
|
| |
OTROS HERPESVIRUS
|
| |
Herpesvirus humano 6
Este
virus se encuentra mundialmente en la saliva de la mayoría de los adultos
(>90%). Infecta casi a todos los niños para la edad de dos años y la
infección es perenne. También, se replica en los linfocitos B y T,
megacariocitos, células de glioblastoma y en la orofarínge. Puede establecer
una infección latente en células que son luego activadas cuando las células
son estimuladas a dividirse. Las células infectadas son más grande de lo
normal con inclusiones tanto en citoplasma como en núcleo. La inmunidad
celular es esencial en el control, aunque la infección es perenne, y el
virus puede reactivarse en condiciones de inmunosupresión. Se desconoce el
receptor para este virus.
Patogénesis
El herpesvirus humano-6 tiene dos formas, VHH-6A y VHH-6B. Este último
causa exantema subitum, también llamada roseola infantum. Esta es una
enfermedad común en niños pequeños (en los EU >45% de los niños son
seropositivos para el VHH-6 para la edad de 2 años) y los síntomas incluyen
fiebre y algunas veces infección del tracto respiratorio superior y
linfadenopatía. Los síntomas perduran varios días luego de un periodo de
incubación de más o menos 14 días. La fiebre remite dejando un sarpullido
macropapular en el tronco y cuello que dura varios días más. En los adultos,
la infección primaria se asocia a mononucleosis. Este virus fue
originalmente aislado de pacientes con enfermedad linfoproliferativa y
pueden co-infectar linfocitos T4 VIH-infectados exacerbando así la
replicación del VIH. Los pacientes con VIH tienen una tasa de infección más
alta que la población normal. El HVH-6 ha sido asociado con un número de
desórdenes neurológicos, incluyendo encefalitis y convulsiones. Ha sido
postulado que juega un papel en la esclerosis múltiple y en el síndrome de
inmunodeficiencia de fatiga crónica.
|
|
|
| |
Herpesvirus humano 7
Este virus se una al antígeno CD4 y se replica en las células T4 (CD4+) y se
encuentra en la salida de la mayoría de la población adulta (>75%). Muchas
personas adquieren la infección cuando niños y ésta permanece con ellos por
el resto de sus vidas. Es similar al VHH-6 y puede ser responsable de
algunos casos de exantema subitum.
|
|
|
| |
Herpesvirus humano 8
Anteriormente conocido como el herpesvirus asociado al sarcoma de Kaposi, se
encuentra en la saliva de muchos pacientes con SIDA. Este infecta linfocitos de
sangre periférica. La distribución del virus explica porqué algunas poblaciones
de personas infectadas con el VIH sufren de sarcoma de Kaposi y otras no. Para
mayor información refiérase a la sección de SIDA/VIH.
|
| |
Herpes B
Este es un
virus de simios que se encuentra en monos del viejo mundo tales como lo macacos
pero podría convertirse en un patógeno humano en personas que trabajan monos (mediante
transmisión por mordeduras). En los humanos, la enfermedad es mucho más
problemática que en su huésped natural. De hecho, cerca del 75% de los casos en
humanos resultaron en muerte y en serias complicaciones neurológicas (encefalitis)
en los casos de sobrevivientes. También hay evidencia de que la enfermedad puede
transmitirse de un humano infectado por mono a otro humano. In vitro el
virus es sensible a Aciclovir y Ganciclovir y estos son recomendados como
tratamiento. Su eficacia es desconocida.
|
|
|
 Regreso a la sección de
Virologia
Microbiología e Inmunología on line
Regreso a la sección de
Virologia
Microbiología e Inmunología on line
Esta página se modificó
recientemente en
Saturday, October 29, 2016
Mantenimiento de la pagina por
Richard Hunt
|

 FIGURA
1
Clasificación de los Virus Herpes
FIGURA
1
Clasificación de los Virus Herpes Empacado tipo fagosoma líquido-cristalino del AND encapsidado en un Virus de
Herpes Simplex
(F.P.Booy, W.W.Newcomb, B.L.Trus, J.C.Brown, T.S.Baker, y A.C.Steven, en
CELL, Vol 64 pp. 1007-1015, Marzo 8, 1991)
Empacado tipo fagosoma líquido-cristalino del AND encapsidado en un Virus de
Herpes Simplex
(F.P.Booy, W.W.Newcomb, B.L.Trus, J.C.Brown, T.S.Baker, y A.C.Steven, en
CELL, Vol 64 pp. 1007-1015, Marzo 8, 1991)
 ”Espinas” glicoproteicas en la superficie del VHS. Se visualiza claramente
la Glicoproteína B (gB) en cúmulos de espinas de 10nm de longitud. Entre la
cápside y la envoltura hay una capa proteica mal definida, conocida como
tegumento.
Derechos reservados
Dra. Linda M Stannard,
Universidad de Cape Town, Sudáfrica, 1995 (usado con autorización)
”Espinas” glicoproteicas en la superficie del VHS. Se visualiza claramente
la Glicoproteína B (gB) en cúmulos de espinas de 10nm de longitud. Entre la
cápside y la envoltura hay una capa proteica mal definida, conocida como
tegumento.
Derechos reservados
Dra. Linda M Stannard,
Universidad de Cape Town, Sudáfrica, 1995 (usado con autorización)
 Virus Herpes Simplex (MTE x169,920)
Derechos reservados
Dr. Dennis Kunkel
(usado con autorización)
Virus Herpes Simplex (MTE x169,920)
Derechos reservados
Dr. Dennis Kunkel
(usado con autorización) La serina proteasa del herpes virus. Haga clic en la imagen a la izquierda
para vincular con una estructura interactiva de la proteasa del
citomegalovirus. Esta proteasa es esencial para la producción de los
viriones infecciosos maduros, puesto que realiza el procesamiento
proteolítico de un precursor de proteína de ensamblaje viral. (Requiere un
plug-in Chime. Adquiera Chime
aquí)
La serina proteasa del herpes virus. Haga clic en la imagen a la izquierda
para vincular con una estructura interactiva de la proteasa del
citomegalovirus. Esta proteasa es esencial para la producción de los
viriones infecciosos maduros, puesto que realiza el procesamiento
proteolítico de un precursor de proteína de ensamblaje viral. (Requiere un
plug-in Chime. Adquiera Chime
aquí) Lesión en el labio inferior de herpes simplex, segundo día luego del
comienzo de la infección.
CDC/Dr. Herrmann
Lesión en el labio inferior de herpes simplex, segundo día luego del
comienzo de la infección.
CDC/Dr. Herrmann
 Lesiones diseminadas afectando múltiples dermatomas
©
Foro Australiano de
Manejo del Herpes
Lesiones diseminadas afectando múltiples dermatomas
©
Foro Australiano de
Manejo del Herpes Síndrome de Ramsay-Hunt afectando la oreja manifestando formación de bulas
en el canal auricular externo
©
Foro Australiano de
Manejo del Herpes
Síndrome de Ramsay-Hunt afectando la oreja manifestando formación de bulas
en el canal auricular externo
©
Foro Australiano de
Manejo del Herpes














































