|
|
|
|
 |
 |
| |
BACTERIOLOGÍA |
INMUNOLOGÍA |
MICOLOGÍA |
PARASITOLOGÍA |
VIROLOGÍA |
|
EN INGLÉS |
BACTERIOLOGÍA – CAPÍTULO SEIS
ANTIBIÓTICOS - SÍNTESIS DE PROTEÍNAS, SÍNTESIS DE ÁCIDOS NUCLÉICOS Y METABOLISMO
Dr Gene Mayer
Professor Emeritus
University of South Carolina School of Medicine
Traducido por :
Dr. en C. Paula Figueroa-Arredondo
M. en C. Ana Laura Luna-Torres
|
|
VA EL CAPÍTULO 7 |
| |
|
INSTITUTO POLITÉCNICO NACIONAL |
E-MAIL
DR PAULA FIGUEROA |
|
PALABRAS CLAVE
Selectividad
Índice Terapéutico
Bactericida
Bacteriostático
MIC
MBC
Prueba de difusión en disco
Sinergismo de los Antibióticos
Antagonismo de los Antibióticos
Antimicrobiano
Resistencia cruzada
Resistencia Múltiple
|
Principios y Definiciones
Selectividad
Todos los agentes anti-microbianos clínicamente efectivos exhiben
toxicidad selectiva hacia las bacterias mas que hacia el huésped. Es ésta
característica la que distingue a los antibióticos de los desinfectantes. Las
bases para la selectividad variarán
dependiendo del antibiótico particular. Cuando la selectividad es alta los
antibióticos normalmente no son tóxicos. Sin embargo, aún los antibióticos
altamente selectivos tienen efectos secundarios.
Índice Terapéutico
El índice terapéutico se define como el cociente entre la dósis téxica para el huésped sobre la dosis terapéutica efectiva. Cuanto ma alto
el índice terapéutico, major es el antibiótico.
Categorías de los Antibióticos
Los antibióticos se categorizan como
bactericidas si estos matan a las bacterias susceptibles o
bacteriostáticos si estos inhiben reversiblemente el crecimiento de las
bacterias. En general el uso de antibióticos bactericidas se prefiere pero
muchos factores podrían dictar el uso de un antibiótico bacteriostático. Cuando
se usa un antibiótico bacteriostático, la duración de la terapia debe ser
suficiente para permitir la erradicación de la bacteria por las defensas
humorales y celulares. Si se usaran los antibióticos bactericidas, sería para
tratar infecciones del endocardio o las meninges. En tales casos las defensas
del huésped son relativamente inefectivas en estos sitios y los peligros
impuestos por tales infecciones requieren una pronta erradicación de los
microorganismos.
Pruebas de Susceptibilidad a los Antibióticos
Las formas básicas de medir
cuantitativamente la actividad in vitro de los antibióticos son la
concentración mínima inhibitoria (MIC) y la concentración mínima
bactericida (MBC). La MIC es la concentración más baja del antibiótico que
da como resultado la inhibición de crecimiento visible (p.ej. colonias en
una placa o turbidez en caldo de cultivo) bajo condiciones estándar. La MBC es
la concentración mas baja del antibiótico que es capaz de matar el 99.9% del
inóculo original en un periodo de tiempo determinado. La Figura 1 ilustra como
determinar la MIC de un antibiótico.
|
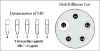 Fig 1 Pruebas de Susceptibilidad a los Antibióticos
Fig 1 Pruebas de Susceptibilidad a los Antibióticos |
| |
Para
que un antibiótico sea efectivo debe ser posible alcanzar la MIC o la MBC en el
sitio de la infección. La absorción farmacológica y la distribución del
antibiótico van a influenciar la dósis, la ruta y la frecuencia de
administración del antibiótico a fin de alcanzar la dosis efectiva en el sitio
de la infección.
En los
laboratorios clínicos una prueba de susceptibilidad a los antibióticos más
común, es la prueba de difusión en disco. En esta prueba el aislamiento
bacteriano se inocula uniformemente sobre la superficie de una placa de agar. Un
disco de papel filtro impregnado con una cantidad estándar del antibiótico se
aplica a la superficie de la placa y se deja difundir el antibiótico hacia el
medio adyacente. El resultado es la formación de un gradiente de antibiótico que
rodea el disco. Después de la incubación, un césped bacteriano aparece sobre la
placa. Las zonas de inhibición del crecimiento bacteriano estarán presentes
alrededor del disco con antibiótico. El tamaño de la zona de inhibición
dependerá de la tasa de difusión del antibiótico, el grado de sensibilidad del
microorganismo y la tasa de crecimiento de la bacteria. La zona de inhibición de
la prueba del disco de difusión está inversamente relacionada con la MIC.
La
prueba se lleva a cabo bajo condiciones estandarizadas y se han establecido
zonas estándar de inhibición para cada antibiótico. Si la zona de inhibición es
igual o mayor que la zona estándar, el microorganismo es considerado como
sensible al antibiótico. Si la zona de inhibición es menor que la zona estándar,
el microorganismo se considera como resistente. La Figura 1 también ilustra
como se forma la zona de difusión del disco y la Figura 2 ilustra algunas de las
zonas estándar de inhibición para varios antibióticos.
Terapia de Combinación
La terapia de combinación con dos o más antibióticos se
usa en casos especiales: (1) para prevenir el surgimiento de cepas resistentes,
(2) para tratar casos de emergencia durante el periodo cuando el diagnóstico del
agente etiológico aún se encuentra en proceso y (3) para sacar ventaja del
sinergismo de los antibióticos.
El
sinergismo de los Antibióticos
ocurre cuando el efecto de una combinación es mayor que la suma de
los efectos de los antibióticos usados individualmente. El antagonismo
de los antibióticos ocurre cuando un antibiótico, usualmente el de menor
efecto, interfiere con el efecto de otro antibiótico.
Antibióticos y agentes Quimioterapéuticos
El término antibiótico se
refiere estrictamente a substancias de orígen biológico mientras que el término agente quimioterapéutico se refiere a un compuesto químico
sintético. La distinción entre estos términos se ha venido borrando debido a que
muchos de nuestros más nuevos "antibióticos" son realmente productos biológicos
modificados químicamente o más aún son productos biológicos químicamente
sintetizados. Los términos genéricos para referirnos ya sea a los antibióticos
o a los agentes quimioterapéuticos son antimicrobianos o agentes
antimicrobianos. Sin embargo, el término antibiótico se usa con frecuencia
para referirse a todos los tipos de agentes antimicrobianos.
|
| |
|
Figura 2
Diámetro de la Zona de los estándares de interpretación y correlaciones
aproximadas de las MIC usadas para definir las categorías de interpretación |
|
Agente Antimicrobiano
(cantidad por disco)
y organismo |
Diámetro de la Zona (miIímetro completos) para cada categoría de
interpretación |
|
Correlación aproximada de MIC (micro gm/ml) para:
|
|
R |
I |
MS |
S |
|
R |
S |
|
Ampicilina (10 microgramos) |
|
|
|
|
|
|
|
Enterobacteriaceae
|
<11 |
12-13 |
|
>14 |
|
>32 |
<8 |
Staphylococcus
spp.
|
<28 |
|
|
>29 |
|
beta-Lactamasa |
<0.25 |
Haemophilus
spp.
|
<19 |
|
|
>20 |
|
>4 |
<2 |
Enterococci
|
<16 |
|
>17 |
|
|
>16 |
|
Otros streptococcos
|
<21 |
|
22-29 |
>30 |
|
>4 |
<0.12 |
|
Cloramfenicol
(30 micro gm) |
<12 |
13-17 |
|
>18 |
|
>25 |
<12.5 |
|
Eritromicina
(15 micro gm) |
<13 |
14-17 |
|
>18 |
|
>8 |
<2 |
|
Ácido Nalidíxico
(30 micro gm) |
<13 |
14-18 |
|
>19 |
|
>32 |
<12 |
|
Estreptomicina
(10 micro gm |
<11 |
12-14 |
|
>15 |
|
|
|
|
Tetraciclina
(30 micro gm) |
<14 |
15-18 |
|
>19 |
|
>16 |
<4 |
|
Trimetoprim
(5 micro gm) |
<10 |
11-15 |
|
>16 |
|
>16 |
<4 |
a
Adaptado del documento (M2-T3) de los NCCLS Octubre de 1983. Para
actualizaciones referirse al documento mas reciente de la MCCLS.
b
R, Resistente; I, intermedio; MS, moderadamente susceptible; S,
susceptible. Un resultado de “I” se debe reportar ya que indica que la
prueba puede estar equivocada y se han de requerir nuevas pruebas
adicionales. Un resultado “MS” deberá reportarse para indicar el nivel
de susceptibilidad que ha de requerir la máxima dosis segura en la
terapia. Las cepas en la categoría “MS” son susceptibles y no
intermedias.
c
MIC que correlacionan aproximadamente y que se usan para definer las
categorías resistentey susceptible. Estas correlaciones no se han de
usar para la interpretación de los resultados de las pruebas de
dilución de antimicrobianos.
|
|
|
|
Revisión de la Síntesis de Proteínas y el Sitio de Acción de Antimicrobianos
que Inhiben la Síntesis de Proteínas
A.
Inicio de la Síntesis de Proteínas – La Figura 3 ilustra la fase de inicio
de la síntesis de proteínas y el sitio de acción de antimicrobianos que
inhiben este proceso.
B.
Alargamiento – La Figura 4 ilustrates el proceso de alargamiento o
elongación y el sitio de acción de antimicrobianos que inhiben este
proceso.
Inhibidores de la Síntesis de Proteínas (la mayoría bacteriostáticos)
La
selectividad de estos agentes es el resultado de diferencias en el ribosoma
procarionte 70S y el ribosoma eucarionte 80S. Debido a que los ribosomas
mitocondriales son similares al ribosoma procariónte estos antimetabolitos
pueden tener alguna toxicidad.
A.
Antimicrobianos que se unen a la Subunidad Ribosomal 30S
1.
Aminoglicosidos
(bactericidas) – Son la estreptomicina, kanamycina, gentamicina,
tobramycina, amikacina, netilmicina and neomycina (tópica).
a.
Modo de acción – Los aminoglicosidos se unen irreversiblemente al ribosoma
30S y detienen el complejo de iniciación 30S (30S-mRNA-tRNA) de manera que
ya no puede ocurrir la iniciación. Los aminoglicosidos también disminuyen la
síntesus de proteínas que ya ha iniciado e induce una lectura errónea del
mRNA.
b.
Espectro de Actividad – Es útil en el tratamiento de muchos gram-negativos y
algunos gram-positivos; No es útil en anaerobios (ya que se requiere del
oxígeno para la incorporación del antibiótico) o bacterias intracelulares.
c.
Resistencia – Es común.
d. Sinergia - Los aminoglicósidos sinergizan con los antibióticos β-lactámicos.
El β-lactamico inhibe la síntesis de la pared cellular y por tanto
incrementa la permeabilidad de los aminoglicósides.
|
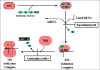 Fig 3
Antibióticos que actúan al nivel del inicio de la síntesis de proteínas
Fig 3
Antibióticos que actúan al nivel del inicio de la síntesis de proteínas
 Fig 4 Antibiótics que actúan al nivel de la fase de alargamiento de la
síntesis
de proteínas
Fig 4 Antibiótics que actúan al nivel de la fase de alargamiento de la
síntesis
de proteínas |
| |
2. Tetraciclinas
(bacteriostáticos) - tetraciclina, minociclina y doxiciclina.
a. Modo de acción – Las tetraciclinas se unen reversibemente al
ribosoma 30S e inhiben la unión del aminoacil-t-RNA al sitio aceptor
del ribosoma 70S.
b. Espectro de actividad - Amplio espectro; Útil contra las
bacterias intracelulares.
c. Resistencia
– Es común
d. Efectos Adversos - Destrucción de la flora normal intestinal que
resulta en incremento de infectiones secundarias; produce manchado y
deapareamiento de la estructura del hueso y de los dientes.
3.
Espectinomicina
(bacteriostático)
a. Modo de acción – La espectinomicina interfiere de manera
reversibe con la interacción del m-RNA con el ribosome 30S. La
espectinomicina es similar estructuralmente a los aminoglicosidos
pero causa lectura errónea del mRNA.
b. Espectro de actividad- Se usa en el tratamiento de
Neisseria
gonorrhoeae resistante a la penicilina.
c. Resistencia - Rara en
Neisseria gonorrhoeae
|
| |
B.
Antimicrobianos que se unen a la Subunidad Ribosomal 50S
1. Chloramfenicol,
lincomicina, clindamicina
(bacteriostáticos)
a.
Modo de acción - Estos antimicrobianos se unen al ribosoma 50S e inhiben la
actividad de la peptidil transferase.
b.
Espectro de actividad.
(1)
Cloramfenicol - Amplio rango
(2)
Lincomicina – y clindamicina – Rango restringido
c.
Resistencia - Común
d.
Efectos Adversos – El Cloramfenicol es tóxico (suprime a la médula ósea)
pero se usa en el tratamiento de la meningitis bacteriana.
2.
Macrólidos
(bacteriostáticos) - Eritromicina
a.
Modo de acción – Los macrólidos inhiben la translocación.
b.
Espectro de actividad - Bacterias Gram-positivas, Mycoplasma, Legionella
c.
Resistencia - Común
C.
Antimicrobianos que Interfieren con los Factores de Elongación (Alargamiento).
1. Fusídico ácido
(bacteriostatic)
a.
Modo de acción – El ácido Fusídico se une al factor de elongación G (EF-G) e
inhibe la liberación de EF-G del complejo EF-G/GDP.
b.
Espectro de actividad- Cocos Gram-positive
Inhibidores de la Función y Síntesis de los Acidos Nucléicos
La
selectividad de estos agentes es el resultado de las diferencias a nivel de
las enzimas procarioticas y eucarioticas que se ven afectadas por el agente
antimicrobiano.
A.
Inhibidores de la Función y Síntesis del RNA
1. Rifampin,
rifamicina, rifampicina
(bactericidas)
a.
Modo de acción – Estos antimicrobianos se unen a la RNA polimerasa DNA-dependiente
e inhiben el inicio de la síntesis del RNA.
b.
Espectro de actividad- Son de amplio espectro pero se usan mas comunmente en
el tratamiento de la tuberculosis
c. Resistencia – Es común
d.
Terapia de combinación – Dado que la resistencia es común, la rifampina se
usa normalmente como terapia de combinación
B.
Inhibidores de la Función y Síntesis del DNA (bactericidas)
1.
Quinolonas
-
ácido nalidíxico, ciprofloxacina, ácido oxolínico
a.
Modo de acción – Estos antimicrobianos se unen a la subunidad A de la DNA
gyrase (topoisomerase), la cual previene el superenrollamiento del DNA, por
lo tanto resulta una inhibición de la síntesis del DNA.
b.
Espectro de actividad – Cocos Gram-positivos e infecciones del tracto
urinario
c. Resistencia – Es común para el ácido nalidíxico; se está desarrollando
para la ciprofloxacina
|
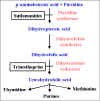 Fig 5 Metabolismo del ácido Fólico
Fig 5 Metabolismo del ácido Fólico |
Antimicrobianos Antimetabolitos
A.
Inhibidores de la Síntesis
del Ácido Fólico - La selectividadn de estos antimicrobianos es una
consequencia del hecho de que las bacterias no pueden usar el ácido fólico pre-formado
y deben sintetizar su propio ácido fólico. En contraste, las células de
mamíferos usan ácido fólico obtenido de la dieta.
Revisión del metabolismo ácido del fólico – La Figura 5 resume la ruta del
metabolismo del ácido fólico e indica los sitios en los cuales actúan los
antimetabolitos.
1.
Sulfonamidas, sulfonas
(bacteriostáticos)
a. Modo
de acción – Estos antimicrobianos son análogos del ácido para-aminobenzóico e
inhiben competitivamente la formación de ácido dihidroptérico.
b.
Espectro de actividad- Actividad de amplio rango contra bacterias gram-positivas
y gram-negativas; se usa principalmente en infecciones del tracto urinario y en
infecciones por Nocardia.
c.
Resistencia – Es común.
d.
Terapia de combinación – Las sulfonamidas se usan en combinación con trimetoprim;
esta combinación bloquea dos distintos pasos en el metabolismo del ácido fólico
y previene la emergencia de cepas resistentes.
2.
Trimetoprim, metotrexato, pirimetamine
(bacteriostaticos)
a. Modo
de acción - Estos antimicrobianos se unen a la dihidrofolato reductasa e inhiben
la formación de ácido tetrahidrofólico.
b.
Espectro de actividad – Amplio rango de actividad contra bacterias gram-positivas
y gram-negativas; se usan principalmente en infeciones del tracto urinario y en
infecciones por Nocardia.
c.
Resistencia – Es Común
d.
Terapia de Combination - Estos antimicrobianos se usan en combinación con las
sulfonamidas; ésta combinación bloquea dos pasos distintos en el metabolismo del
ácido fólico y previene la emergencia de cepas resistentes.
B.
Agentes Anti-Micobacterianos-
Los agentes antimicobacterianos se usan generalmente en combinación con otros
antimicrobianos, ya que el tratamiento es prolongado y la resistencia se
desarrolla rápidamente ante los agentes antimicrobianos usados en forma
individual.
1.
Ácido Para-aminosalicílic (PSA)
(bacteriostático)
a. Modo
de acción - Similar a las sulfonamidas
b.
Espectro de actividad - Específico para Mycobacterium tuberculosis
2.
Dapsona
(bacteriostático)
a. Modo
de acción - Similar a las sulfonamidas
b.
Espectro de actividad- Se usa en el tratamiento de la lepra.
3.
Isoniazida (INH)
(bacteriostático)
a. Modo
de acción – La isoniazida inhibe la síntesis de los ácidos micólicos.
b.
Espectro de actividad- Se usa en el tratamiento de la tuberculosis
c. Resistencia – Ya se ha desarrollado.
|
| |
VI. Resistencia contra las drogas Antimicrobianas
A.
Principios y Definiciones.
1.
Resistencia clínica a los agentes antimicrobianos ocurre cuando la MIC de la
droga para una cepa particular excede a aquella que es capaz de alcanzarse
in vivo en forma segura. La resistencia a un antimicrobiano puede
originarse (1) por mutación en el gene que determina la
sensibilidad/resistencia al agente o (2) por adquisición de un DNA
extracromosomal (plásmido) conteniendo genes de resistencia. La resistencia
que aparece después de la introducción de un agente antimicrobiano en el
medio ambiente, resulta normalmente de un proceso de selección, por ejemplo:
el agente selecciona, es decir, solo permite que el desarrollo a los
sobrevivientes de aquellas cepas que poseen el gen de resistencia. La
resistencia se puede desarrollar en un solo paso o puede resultar de la
acumulación de mutaciones múltiples.
2.
La resistencia cruzada implica que un solo mecanismo confiere
resistencia a múltiples agentes antimicrobianos mientras que la resistencia múltiple implica que están involucrados múltiples
mecanismos. La resistencia cruzada se observa comúnmente en aquellos agentes
antimicrobianos relacionados muy cercanamente, mientras que la resistencia
múltiple se observa con agentes antimicrobianos cuyos mecanismos de acción
no están relacionados.
B.
Mecanismos de Resistencia
1.
Permeabilidad alterada ante el agente antimicrobiano- Una permeabilidad
alterada puede ser atribuído a la incapacidad del agente antimicrobiano para
penetrar en la célula bacteriana o alternativamente para exportar
activamente el agente desde el interior de la célula.
2.
Inactivación del agente antimicrobiano- La resistencia a menudo es el
resultado de la producción de una enzima que es capaz de inactivar el agente
antimicrobiano.
3.
Alteración del sitio blanco – La resistencia se puede producir debido a la
alteración del sitio blanco que reconoce el agente antimicrobiano.
4.
Reemplazamiento de una ruta sensible – La resistencia puede resultar de la
adquisición de una enzima nueva que reemplace la sensible.
|
|
|
 Regreso
a la Sección de Bacteriología de Microbiología e Immunología On-line Regreso
a la Sección de Bacteriología de Microbiología e Immunología On-line
El mantenimiento de ésta página es conducido por
Richard Hunt
|

 Fig 1 Pruebas de Susceptibilidad a los Antibióticos
Fig 1 Pruebas de Susceptibilidad a los Antibióticos Fig 3
Antibióticos que actúan al nivel del inicio de la síntesis de proteínas
Fig 3
Antibióticos que actúan al nivel del inicio de la síntesis de proteínas Fig 5 Metabolismo del ácido Fólico
Fig 5 Metabolismo del ácido Fólico