| x | x | |||||
 |
||||||
| BAKTERIYOLOJİ | İMMÜNOLOJİ | MYCOLOGY | PARASITOLOGY | VİROLOJİ | ||
|
|
|
|||||
| En Español | ||||||
|
Let us know what you think FEEDBACK |
||||||
| SEARCH | ||||||
|
|
||||||
|
|
||||||
|
|
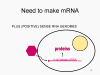
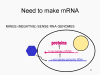
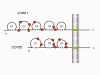
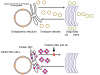
RNA virüsleri çift sarmal RNA daha ziyade tek iplikli genomludur (Bunun aksine ökaryotik hücre DNA'sınsa olduğu gibi, DNA virüsleri, çift sarmal DNA içerir). DNA transkripsiyon sırasında daha kolay çözülür halbuki çift zincirli RNA çok kararlıdır (bunun erime sıcaklığı benzer bileşimli bir DNAdan on derece yüksektir). Ayrıca, DNA açılmasının aksine RNA açılması, hücresel DNA, DNA veya mRNA transkripsiyonu olduğu zaman gerçekleşen konak hücre mekanizması değildir. RNA virüsünün iki temel türü bulunmakta; biri DNA olmadan yeni RNA'yı kendi RNA kopyalayanlar ve diğeri DNA ara madde kullananlardır (Şekil 1a ve b). Eskiden, pozitif iplikli RNA virüsleri (örneğin çocuk felci ve rino virüsler gibi picornavirüsler), negatif iplikli RNA virüsleri (örneğin grip) ve çift dallı RNA virüsleri (örneğin, rotavirüsler) içerir. Bir DNA ara maddesine sahip RNA virüsleri Retrovirüslardır (Şekil 1 a ve c).
DNA safhasına sahip olmayan RNA virüsleri, RNA RNA
kopyalaması konak hücre fonksiyonu olmadığı için, bir RNA'ya bağımlı RNA
polimeraz (bu da bir replikaz olarak adlandırılır) kodlamaktadır. Bu tür
virüsler tipik olarak tüm yaşam döngüsü boyunca sitoplazmadadır.
Retrovirüsler, pozitif iplikli RNA virüsleridir ve daha sonra bir konak
enzimi, RNA polimeraz II ile genomik RNA'ya transkribe edilmiş DNA
provirüsünü oluşturmak için bir RNA-bağımlı DNA polimerazı (ters
transkriptaz) gerekir. RNA polimeraz II konak hücre çekirdeğinde mRNA
yaptığından, retrovirüslerin yaşam döngüsü çoğunlukla çekirdekte yer
alır. Tüm hayvan RNA virüsleri kendi polimerazını kodlarlar ancak bir
istisna vardır ki, hepatit delta ajanıdır ve bu gerçek bir virüs
değildir. RNA dan RNAya kopyalamak için nornalde RNAdan DNAya
kopyalayan bir konakçı enzim kullanılabilir.
|
|||||
|
|
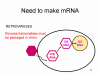
VIRAL MESSENGER RNA RNA virusuna konak hücrede protein sentezi için mesajcı RNA olarak hizmet edebilecek bir RNA oluşturmak gereklidir. Pozitif tek iplikli RNA virüslerinin durumunda, genomik RNA) (genomu, tanım olarak, mRNA ile aynı anlamda) mesaj olarak hizmet edebilir (Şekil 2). Virüs kapsidi sitoplazmaya dağıtım aracı olarak hizmet vermektedir. Genom RNA polimerazı ile kopyalanan bir RNA olduğundan, proteini kodlayan genlerin (DNA virüsları veya retrovirüslarda bulunduğu gibi) yukan tipik promotörüne (TATA kutusu, CAT kutusu gibi) ihtiyaç yoktur; dahası, kendi RNA'sını bir mesaj olarak doğrudan kullanabildiğinden, mRNA yapmadan önce pozitif iplikli virüsler yeni proteinleri yapma gereklilikleri yoktur. Buna karşılık, negatif iplikli virüsleri ile enfekte olmuş hücrelerin, pozitif sens mRNA yapılmadan önce bir proteini (polimeraz) bulundurması gerekiyor ve bu yüzden, virüs kapsidinin içinde polimeraz taşımak zorundadır ve enfekte olmuş bir hücreye, bu proteini sağlar (Şekil 3). Buna ek olarak, gelen negatif sens genomik RNA'dan kopyalanan sens mRNA konak hücre tarafından çevrilmesi için hücresel mRNA'nın (metil başlıklı, poly A kuyruğunu) normal değişikliklerinin olması gerekir. Değiştirici enzimler (metilaz, GMP transferaz, poli A polimeraz), aynı zamanda gelen virüsun paketinde olmalı anlamına gelir. Konak hücre bu enzimleri sağlayabilmesine rağmen, onlar çekirdekde bulunur (mRNA'nın yapıldığı yer) ve yukarıda belirttiğimiz gibi, çoğu RNA virüsleri kendi yaşam döngüsü boyunca sitoplazmiktir. Retroviruslarda proteinler yapılmadan önce RNA'dan
DNA'ya kopyalama gereklidir ve böylece polimeraz (ters
transkriptaz),virüs parçacığı içinde paketlenmelidir (Şekil 4). Bu RNA
virüsleri, ancak konak hücrenin çekirdeğinde genomunu çoğaltır ve
böylece konak hücre RNA modifikasyon enzimlerini kullanılabilir.
MONOSİSTRONİK RNA PROBLEMİ Ökaryotik hücreler, polisistronik mRNA'lara sahip
bakterilerin aksine, monosistronik mRNA'lara sahiptir. Bir protein için
bir monosistronik mRNA kodladığından, ribozom mRNA'nın 5 'ucu yakınında
bir translasyon başlatma yeri bulur ve bir durdurma kodonu gelinceye
kadar protein translasyonu olur. mRNA içinde protein sentezinin internal
başlangıcı (nadir durumlar dışında) oluşmaz. Bir tek RNA ökaryotlarda
birden fazla protein için kodlama yapar ancak bu bir monosistronik mesaj
olarak gören başka bir mRNA'dan için orijinal transkriptin bölümlerini
birleştirilerek yapılır. Ekleme enzimleri bu süreci yürütmek için
çekirdeğinde bulunur (Bu mRNAların yapıldığı yer olduğundan). RNA
virüsleri normalde sitoplazmik olduklarından, birleştirme enzimlerinin
avantajlarından yararlanamazlar. Bu durumda, sadece tek bir mRNA sahip
RNA virüsleri tek bir büyük proteini yapabilmelidir, ancak onlar bir
dizi hilenin (şekil 5) üstesinden gelmek için gelişti ve gerçekte,
birden fazla protein yapar. Bazıları, konak hücrelerin alternatif
birleştirme enzimlerinin avantajlarını alabilir (ve bu nedenle, bir
nükleer aşama olması gerekir). Diğerleri bir proteaz aktivitesine sahip
tek bir büyük proteini yapar; Bu daha küçük bir protein dizisini büyük
prekürsöre kadar keser. Picornavirüslerin gibi, diğerleri bir ökaryotik
hücrede olsa bile bir polisistronik şekilde tek bir mRNA işlevi yapmak
için yollar buldular.
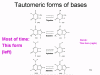
KANIT OKUMA PROBLEMİ İnsan DNA genom kopyalaması yapılırken, DNA'nın
yeni kopya hatalarını düzelten bir kanıt okuma DNA polimeraz kullanıldı.
Çok fazla hata oluşur çünkü DNA kodu oluşturan bazların normal hali
ender totomerik formlarda bulunabilir (Şekil 6). Bu nadir biçimleri çok
kısa süreler için bulunmaktadır ancak, bir baz kopyalanırken o zaman
kendi tautomerik formunda ise, DNA sentezi sırasında yanlış baz olarak
okunur. Böylece, normalde T ile A eşleşir ama T'nin nadir tautomeri ile
G bazı eşleşir ve buna göre kopyalanabilir. RNA polimeraz normalde
kanıtı okuma yapmaz ve bu yüzden bu mutasyonlar düzeltilemez ve gelecek
nesillerde süreklilik olabilecektir. RNA polimeraz II'nin mutasyon oranı
yaklaşık 1/ 10,000 ve böylece RNA virüslerinin mutasyon yükünü düşük
tutmak için, bunlar küçük genomlara sahip olmalıdır. Genellikle, RNA
virüsleri 10,000 nükleotid ya da daha küçük genomlara sahipdir (örneğin,
yaklaşık 150.000 nükleotidlik genomlara sahip olan herpes virüslarla
karşılaştırıldığında).
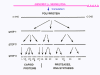
NİÇİN TÜM BU MUTASYONLAR RNA VIRUSLARINI KARARSIZ YAPMAZ? HIVde (sadece10,000'den az nükleotid genom
boyutuna sahip), polimorfizm popülasyonuna neden olan ve virüsu
anti-viral ilaçlara dirençli hale sağlayan birçok mutasyon birikir.
Ancak, birçok RNA virüsleri (örneğin çocuk felci virüsü) yüksek mutasyon
oranlarına rağmen, binlerce yıl boyunca çok istikrarlı olmuştur. Bu en
iyi Müllerian manzara uygunluk kavramı ile bu açıklanabilir. Bu kavrama
göre, belirli bir virüs suşu da (örneğin, insanlarda çocuk felci)
belirli bir konak organizmada replikasyona uyarlanabilir. Aynı veya daha
iyi sonuçlar getirebilen virüsün diğer formlarıda olabilir ama ama virüs
başka bir forma mutasyona daha iyi adapte olan bir forma geçmesi gerekir.
Böylece, daha iyi adapte olan virüs mutasyona uğradığında, mutant virüs
rekabet edemez ve dışarı seyreltilir. Diğer bir deyişle, iyi adapte
virüsler kendi nişinde uygunluğun bir pikini yapar ve zayıf
adaptasyonunun vadisini çaprazlayamaz (Şekil 7). Onlar kanyon katta sert
koşullara adapte olamaz ve bu nedenle çiftleşmediklerinden, bu
farklılıklar göstermiş Büyük Kanyon'un kuzey ve güney jantları üzerinde
sincaba benzer.
KÜÇÜK GENOM BOYUTUNUN SONUÇLARI Küçük bir genom kodlanmış olabilen proteinlerin
sayısını kısıtlar (Şekil 8). Gördüğümüz gibi, RNA ve virüs tarafından
yapılması gereken polimerazı korumak için bir kapsid proteini olması
gerekir. Ayrıca bir bağlanma proteini olması gereklidir böylece virüs,
yeni bir hücreyi enfekte edebilsin. Bu nedenle, RNA virüsleri, çeşitli
proteinlerin birden fazla kopyasını kullanarak oldukça büyük
olabilmesine rağmen, bireysel proteinlerin sayısı sınırlı olacaktır.
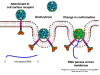
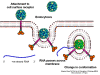
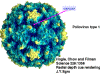
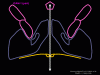
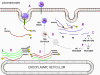
YAŞAM SİKLUSU Polio (şekil 9) and rhinoviruslar picornavirusdur. Onlar küçük, ikosahedral, pozitif sense RNA viruslarıdır ve bir zarf (çift katlı lipid) içermezler. Picornaviruslarda hepatit A virüsü ve enterovirüsları da bulunmaktadır. Bu virüslerin tüm yaşam döngüsü, konak hücrenin sitoplazmasında oluşur. RNA mRNA gibi aynı anlamda olduğundan, yalnız RNA, tam bir virüs partikülüne göre daha az oranda olsa bile bulaşıcıdır. Virüs, hücre yüzeyine bağlanmak için proteinlere sahip olmalıdır. Hemen hemen tüm diğer
virüslerinde olduğu gibi pikornavirüsler, özel bir reseptör ile konak
hücreye bağlanır ve hücre tarafından içselleştirilir (Şekil 10). Çocuk
felci ve rino viruslarında, bu CD155, çocuk felci virüsü reseptörü veya
PVR olarak da bilinen, normal hücrelerde fonksiyonu bilinmeyen bir
proteindir. Bir proteini olan vitronektin bağlanan CD155'in normal
fonksiyonu ile ilgili bazı ipuçlarına sahibiz bu nedenle, bunun hücre
dışı matrikse, bir hücre bağlanmasında rol oynayan bir yapışma proteini
olabilir. Rinovirüslerin büyük bir kısmı ayrıca CD54 ya da ICAM-1 (hücre
içi yapışma molekülü-1) olarak adlandırılan bir yapışma proteini olan
başka bir reseptöre bağlanabilir; bu reseptörlerin kullanılması
virüslerin karakteristik tropizmine yol açan, bulaşılabilir hücreleri
kısıtlar, örneğin, CD155 bağırsakta ve nöromüsküler kavşakta presinaptik
membranda yer alan bir akson terminalinde de dahil olmak üzere pek çok
hücre tipinde ifade edilir. C D155 ve ICAM-1 zar içinde sabitlenmiş olan
glikoproteinlerdir (Şekil 11D). Pikornavirüs bağlanan hücre dışı
bölgeleri, immünoglobülin benzeri kıvrımlar ile, sırasıyla üç ve beş
immünoglobülin benzeri domaine sahiptirler. Her durumda virüs,
N-terminal alanına bağlanır. CD155 kısa ve kanyon (şekil 11E) boyunca
yatıyorken, ICAM-1 uzun ve kanyonun (Şekil 11C, D) içine derin çıkıntı
yapmaktadır. Rhinoviruslar ICAM-1 ile hücreye bağlanırken, neler olduğuna detaylı bakacak olursak; Viral proteinlerden biri hücre zarına gömüldükden sonra RNA pentonun merkezi yoluyla membrandan hücreye girecek. Biz pentondan (biz aşağı baktığınızda beş kat simetriye sahiptir) (şekil 12) bir kesit alırsak, kapalı por çevreleyen penton merkezi parçasından VP1 molekülleri görebilirsiniz. VP1- kanyonda VP2 / 3'e karşı yer almaktadır. Ama kanyonun zemini düz değil. Zemin altında Cep olarak bilinen büyük bir alanda dar bir delik vardır. Normalde, bu cep "cep faktörü" içerir. Bu hiç izole edilmemiş ve karakterizedir ancak kristalografik yapı çalışmaları uzun yağ asit benzeri molekül olarak görünür. Aşağıda dış proteinler, VP1, VP2 ve VP3 olup, (Şekil 12'deki gibi) dışarıdan görülemeyen bir virüs proteini de VP4. Şekil 13, iç kümede daha genel bir yapıya sahip penton proteinlerinin omurgasını gösterir. Şekil 14 ICAM-1 molekülünün VP1 / 2/3 kompleksine nasıl sığdığını göstermektedir. Unutmayın; kanyon içine sığar, ancak cebe penetre olmaz. Biz şimdi belirtilen proteinlerin omurgalarını şekil 15 ile tekrar görüyoruz. Pikornavirüs
enfeksiyonları tedavi etmek için kullanılmış ilaçların bir sınıfı, WIN
ilaçları. Onlar virüs ve ICAM-1 etkileştiğinde yapısal değişikliğini
durdurur ve şekil 16'da ne olacağını görebilirsiniz. WIN ilaç "cep
faktörü" yerini alır ve cep içine uyar (şekil 17) ve biz bir uzay
doldurma görüntüsünde pentona (Şekil 18) baktığınızda neredeyse tamamen
gömüldüğünü görürüz. ICAM-1 kanyona bağlandığı zaman, penton merkezinden uzakta VP1 ipuçları ve yapısal değişim vardır (Şekil 21). Bu cebi sıkıştırır ve bağlanma cep faktörünü değiştirmesi mümkündür. WIN ilaçları cep faktörde daha güçlü cebe bağlanır ve ICAM-1 bağlanmasını yerinden değiştiremez. Böylece, gözenek açmak için eğme oluşmaz (Şekil 21 b). VP1 uçları gerilediğinde VP3 dışa hareket ederek gözenek açılır (şekil 21b, c). Bu VP4'e gözenek (kanal) içinde hareket etmesine olanak sağlar. VP4'ün amino terminali bir miristik asittir (yağ asidi) ve gözenek aracılığıyla bazı hamleler yapar. Gözenek beş kat simetriye sahiptir ve orada gerçekten bu beş VP4 proteinleri kanalı zorlar. Miristik asitler gözenek oluşturmak için hücre zarının ikili lipid tabakasına gömülür. Gözenek oluşumu ayrıca VP1 amino terminalinin antipatik alfa sarmal olduğu gerçeği ile ICAM-1 bağlanma üzerinde döndürmesine yardımcı olur. VP1-4 tetramer yapısından
beklenebileceği gibi, VP4ün virüsün dışına anti-VP4 antikorları
tarafından bağlanmamış olması gerekir. Virüs uzun süre çözeltide
bırakılırsa, VP4, virüs "nefesler" olarak etiketlenmiş olur. Bir WIN
ilaç cebe bağladığında, cebe ilacın sıkı bağlanması virüsün yapısını
stabilize ettiğini gösteren böyle nefes durdurur. Beklenebileceği gibi,
kanyona bağlanan ICAM-1 molekülünün bir parçası eklenirse, RNA
gözenekten çıkar ve orada bir şekil değişikliği ile virüs artık bulaşıcı
olmaktan çıkar. Penton sadece enfekte olan hücre içine RNA için çıkış
yeri değil, ayrıca nükleokapsit içine RNA için giriş yeridir. |
|||||
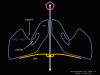
Şekil 12, Rhinovirüs Penton Proteinlerin Düzenlenmesi
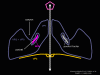 Şekil 16, WIN ilaçları cep faktörü yerini değiştirmesi
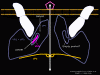 Şekil 21b. ICAM-1 bağlandığı zaman VP 1,2,3 karmaşık ipuçları gözenek açmak için cep faktörü muhtemelen yerinden olmuştur. Bir WIN ilaç cep faktörünün yerini aldığında, bu yapısal değişiklik oluşmaz
|

Şekil 13, Penton proteinlerinin Omurga yapısı

Şekil 21c, ICAM-1 bağlanması, gözenek açılması ile sonuçlanır, virüs bağlı olan hücre zarına, (aynı zamanda gözenek geçebilir) VP1 ve VP4 parçalarının gömülmesi ile hücre membranında gözenek oluşturur. RNA, virüs pentonunun gözeneği yoluyla konak hücreye geçebilir
|
|||||
|
|
Picornaviruslar başlatma kompleksinin proteinlerinden birini, eIF4G (Şekil 25),kesebilen bir proteaz etkinliğe de sahiptir ve bu normal kapaklı mesajları çevirmek için hücrenin yeteneğini ciddi şekilde etkiler ama IRES'den gelen çevirilerietkilemez; böylece virüs konak hücre çevirisini bastırırken, etkilenmemiş kendi RNA çevirisine devam eder. Sadece bir IRES olduğu gerçeği tek primer çeviri
ürünü olduğu anlamına gelir; yani sadece yapılan bir büyük proteini
olabilir. Bu protein, sonunda olgun virüsda birkaç protein yapmak için
kesilecek ve böylece birden fazla gen (cistron) tarafından kodlamakta
olduğundan bu birincil ürüne polisistronik protein diyoruz. Orijinal
poliproteini kesen proteazlar virüs genomunda kodlanır ve şekil 26'da
gösterildiği gibi proteolitik süreç sipariş edilir.
|
|||||
 Şekil 24, Pikornavirüs RNA'sında ic ribosom giriş sitesi (IRES) olarak adlandırılan ikincil yapısının bir bölgesi vardır
 Şekil 26, Orijinal poliproteini kesen proteazlar virüs genomunda kodlanır ve proteolitik süreç sipariş edilir |
||||||
|
|
RNA
REPLIKASYIONU
|
|||||
|
|
BİRLEŞME P1 sonra virüs kapsidinin altünitesi oluşturan üç proteine (VP0, VP1, VP3) ayrılır. Bu, poliproteinin ve tek birincil çeviri ürünün katalitik bir parçası olarak virüs spesifik proteazlar tarafından yapılır. VP0, VP1- ve VP3, 5S yapısal alt birimi (protomeri) içine monte edilir. Virüs bir arayaya geldiği zaman VP0 sadece VP2 ve VP4'e bölünmektedir. Bu protomerlerin beşi bir 14S pentamerin içine monte edilir ve oniki pentamerler procapsid oluştururlar. RNA, bir provirion oluşturmak üzere procapsid içine kapsüllenmiştir. B u aşamada, VP0 de VP2 ve VP4 ayrılır ve virion olgun ve virüs parçacığı infeksiyözdür. RNA, bir provirion oluşturmak üzere procapsid içine kapsüllenmiştir. Bu aşamada, VP0 de VP2 ve VP4 ayrılır ve virion olgun ve virüs parçacığı infeksiyözdür. RNA enkapside ise VP0 sadece ayrılır. Primer çeviri ürününün diğer 2 parçası (P2 ve P3)
yapısal olmayan proteinleri meydana getirmek üzere ayrılmaktadır (örneğin,
olgun virüs parçacık içinde yer almayan ancak, enfekte hücrede
replikasyon sırasında kullanılan proteinler). Bu replikazı ve konak
hücre metabolizmasını değiştiren proteinleri içerir. Pozitif sens
genomik RNA moleküllerinin her birinin ucunda bulunan VPg proteini P3
parçasından oluşturulur. |
|||||
|
SALINIM |
||||||
|
|
||||||
|
||||||